湖北2018年高一上半年化学期中考试免费试卷完整版
| 1. 选择题 | 详细信息 |
|
下列对古文献记载内容或诗句谚语理解不正确的是 ( ) A. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏 B. “水滴石穿、绳锯木断”不包含化学变化 C. 《梦溪笔谈》记载:“熬胆矾铁釜,久之亦化为铜”中涉及到的反应有置换反应 D. “忽闻海上有仙山,山在虚无缥缈间”中的海市蜃楼是一种自然现象,与胶体知识有关 |
|
| 2. 选择题 | 详细信息 |
|
下列操作或事故处理不正确的是 ( ) A. 在点燃H2前,必须检验气体的纯度 B. 在稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 C. 点燃盛满酒精的酒精灯 D. 给试管中的液体加热时,液体体积不超过试管容积的三分之一 |
|
| 3. 选择题 | 详细信息 |
|
下列物质分类正确的是 A. CO2、NO2均为酸性氧化物 B. 有尘埃的空气、墨水均为胶体 C. 烧碱、蔗糖均为电解质 D. 胆矾、盐酸均为混合物 |
|
| 4. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 1 mol O2的质量是32 g/mol B. 对原子而言,摩尔质量就是相对原子质量 C. H2的摩尔质量是2 g D. H+的摩尔质量1 g/mol |
|
| 5. 选择题 | 详细信息 |
|
下列实验操作正确的是 ①用分液漏斗分离酒精和水 ②用10 mL量筒量取6.2 mL稀硫酸 ③配制100 mL1.00 mol/LNaCI溶液时,用托盘天平称量5.85g氯化钠晶体 ④用蒸发皿高温灼烧石灰石 ⑤洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 ⑥用500 mL容量瓶配制480 mL 0.2 mol/L的NaOH溶液 A. ②⑥ B. ③⑥ C. ①④ D. ①⑤ |
|
| 6. 选择题 | 详细信息 |
|
下列有关物质检验的实验结论正确的是 A. 向某溶液中加入硝酸酸化的氯化钡溶液,生成白色沉淀,原溶液中一定含有SO42- B. 向某溶液中加入硝酸银溶液,生成白色沉淀,原溶液中一定含Cl- C. 向某无色溶液中滴入无色酚酞试液显红色,原溶液一定显碱性 D. 向某溶液中加入盐酸,产生无色气体,原溶液中一定含有大量CO2 |
|
| 7. 选择题 | 详细信息 |
|
设NA是阿伏加德罗常数的值,下列说法正确的是 A. 常温常压下,22.4 L氮气中含有的分子数目为NA B. 标准状况下,18 g水中含有的原子总数为3NA C. 56 g铁与足量盐酸反应转移的电子数为3NA D. 1 L 1mol/L CH3COOH溶液中,含有的氢离子总数为NA |
|
| 8. 选择题 | 详细信息 |
|
下列溶液中Cl-的物质的量浓度最大的是 A. 150 mL1 mol/L NaCl溶液 B. 50 mL2mol/L NH4Cl溶液 C. 150 mL 0.5 mol/L CaCl2溶液 D. 50 mL l mol/L AlCl3溶液 |
|
| 9. 选择题 | 详细信息 |
|
下列有关Fe(OH)3胶体和FeCl3溶液的说法正确的是 A. 两者均能透过滤纸 B. Fe(OH)3胶体有丁达尔效应是Fe(OH)3胶体区别于FeCl3溶液最本质的特征 C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 D. FeCl3溶液呈电中性,Fe(OH)3胶体带正电 |
|
| 10. 选择题 | 详细信息 |
|
在某澄清透明的溶液中,下列各组离子中能大量共存的是 A. K+、H+、SO42—、OH— B. Ba2+、K+、SO42—、NO3— C. Na +、H+、Cl—、CO32- D. Na +、Cu2+、Cl-、SO42— |
|
| 11. 选择题 | 详细信息 |
三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示,化合物X通过红外光谱仪测定其含有NO3-,下列说法不正确的是 ( )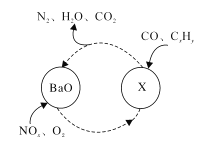 A. X的化学式为Ba(NO3)2 B. 图示的转化中,被还原的元素是N、O C. 图示生成X的转化中NOx做氧化剂 D. 图示中的所有转化均为氧化还原反应 |
|
| 12. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是 A. 醋酸滴在石灰石上:CO32—+2CH3COOH═CH3COO—+H2O+CO2↑ B. 稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ D. 铜片插入硝酸银溶液中:Cu+2Ag+═2Ag+Cu2+ |
|
| 13. 选择题 | 详细信息 |
|
下列配制的溶液浓度偏低的是 ( ) A. 配制硫酸用量筒量取硫酸时仰视读数 B. 配制硫酸定容时,仰视容量瓶刻度线 C. 配制NaOH溶液,NaOH溶解后未经冷却即注入容量瓶定容至刻度线 D. 称量25.0g胆矾配制1 mol/L CuSO4溶液100 mL时,砝码错放在左盘 |
|
| 14. 选择题 | 详细信息 |
|
某单原子分子构成的气体,其摩尔质量为M g/mol,该气体的质量为mg,设阿伏加德罗常数的值为NA,则下列说法错误的是 ( ) A. 该气体在标准状况下的密度为2240/M B. 该气体所含的原子总数为mNA/M C. 该气体在标准状况下的体积为22.4m/M L D. 该气体一个分子的质量为M/NA g |
|
| 15. 选择题 | 详细信息 |
|
某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染。已知NaNO2能发生反应:2NO2-+ xI- + yH+ = 2NO↑+ I2 +2H2O(已配平),下列说法不正确的是 A. 上述反应中,x=2,y=4 B. 上述反应的氧化剂与还原剂物质的量之比为1:1 C. 若反应中转移1 mol电子,则生成的NO的体积为22.4 L D. 为使NaNO2转化为无污染的N2后再排出,可选用的试剂是NH4Cl溶液 |
|
| 16. 综合题 | 详细信息 |
“探险队员” 盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则无法通过。 (l)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):盐酸→___ → ___→⑩→⑦→___ →⑫ (2)在能“吃掉”盐酸的化学反应中,属于非氧化还原反应的有 ___个,能“吃掉”盐酸的盐与足量的盐酸发生反应的离子方程式为____。 (3)在不能与盐酸反应的物质中,属于电解质的是______(填物质前的序号,下同),属于非电解质的是 ___,熔融状态能导电的是____。 |
|
| 17. 实验题 | 详细信息 |
青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156 --157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示: (l)对青蒿干燥破碎后,加入乙醚的目的是_________________。 (2)操作I需要的玻璃仪器主要有烧杯、 ___,操作Ⅱ的名称是___________。 (3)操作Ⅲ的主要过程可能是____(填字母)。 A.加水溶解,蒸发浓缩、冷却结晶 B.加95%的乙醇,浓缩、结晶、过滤 C.加入乙醚进行萃取分液 (4)在用分液漏斗进行分液操作时,为使液体顺利滴下,应进行的具体操作是____,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿 烧杯壁流下。分液后漏斗内剩余的液体从分液漏斗的 ___(填“上口”或 “下口”)倒入烧杯。 |
|
| 18. 实验题 | 详细信息 |
实验室需要0.2 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: (l)如图所示的仪器中配制溶液一定不需要的是 ___(填字母序号),配制上述溶液还需用到的玻璃仪器是____填仪器名称)。 (2)在配制NaOH溶液时: ①根据计算,用托盘天平称取NaOH固体____g; ②若NaOH溶液在转移至容量瓶时,洒落了少许,则配置的溶液浓度_____填“偏高”、“偏低”或“无影响”)。 (3)在配制硫酸溶液时: ①所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为____mL(计算结果保留一位小数); ②如果实验室有15 mL、20 mL、50 mL量筒,应选用 ___mL量筒最好。 |
|
| 19. 填空题 | 详细信息 |
|
按要求回答下列问题: (l)已知反应H2S + 2HNO3(浓)=3S↓+ 2NO2+2H2O,该反应的还原剂是_______,氧化产物是____,生成16gS转移的电子数为____。 (2)Cu2S(Cu显+1价)与一定浓度的HNO3反应生成Cu(NO3)2、CuSO4、NO和H2O,反应的化学方程式为____。 (3)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值为____。 |
|
| 20. 填空题 | 详细信息 |
向NaOH和Ba(OH)2的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,试回答: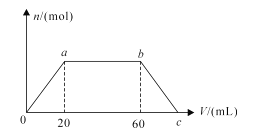 (1)0到a点之间的反应的化学方程式:__________________; (2)a到b点之间的反应的离子方程式:_____________________; (3)b点之后的反应的离子方程式:____________________; (4)c点CO2的体积___ mL(同温同压下); (5)混合溶液中NaOH和Ba(OH)2的物质的量之比为_______________。 |
|
高中化学 试卷推荐
- 2016-2017年高一下册化学开学考试题免费试卷(广西省桂林市桂林中学)
- 2017-2018年高二上半年12月联考化学试卷(武汉市蔡甸区汉阳一中、江夏一中)
- 2017-2018年高一12月月考化学试卷(宁夏育才中学学益校区)
- 2017-2018年高二上期期中考试化学考卷带参考答案和解析(陕西省渭南市尚德中学)
- 高中化学人教版 必修2 第一章 物质结构 元素周期律 第一节 元素周期表 元素性质与原子结构
- 2017-2018年高二上期第二次联考化学在线测验(福建省永安一中、德化一中、漳平一中)
- 2016-2017年高二下册期中考试化学在线测验(福建省永春县第一中学)
- 2018届高三上期11月月考理综化学考题带答案和解析(广东省佛山一中)
最近更新



