2018黑龙江高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
金属的使用是人类拓展自身能力的标志之一.人类利用几种常用金属的先后顺序依次为金、铜、铁、铝,之所以有先后,主要取决于( ) A.金属在地壳中的含量多少 B.金属的熔沸点高低 C.金属的活泼性强弱 D.金属的导电性强弱
|
|
| 2. | 详细信息 |
|
下列关于元素及其化合物的说法不正确的是( ) A.Fe在一定条件下可与浓盐酸、稀硫酸、浓硝酸等剧烈反应 B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用不相同 C.在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解 D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱
|
|
| 3. | 详细信息 |
|
下列化合物能用相应元素的单质直接化合生成的是( ) ①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2S ⑧FeCl3. A.②③⑤⑦⑧ B.①④⑥⑦ C.①②③⑦⑧ D.②③⑤⑥⑦⑧
|
|
| 4. | 详细信息 |
|
由钠、镁、铝、锌四种金属单质中的两种组成的合金共12g,跟足量的 A.Na B.Mg C.Al D.Zn
|
|
| 5. | 详细信息 |
|
将0.02 molN A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O=2Na++2OH-+H2↑ B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些 C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 D.三个烧杯中生成氢气的物质的量相同
|
|
| 6. | 详细信息 |
|
钠铝合金(常温液态)可作为核反应堆的载热介质.下列说法正确的是( ) A.该合金的熔点高于金属钠的熔点 B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Al)>n(Na) C.若将钠铝合金投入Fe D.等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少
|
|
| 7. | 详细信息 |
|
m g某金属M与含n mol HCl的盐酸恰好完全反应,生成MCl2和H2,则该金属的相对原子质量为( ) A.2m/n
|
|
| 8. | 详细信息 | ||||||||||||||||||||
|
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
|
|||||||||||||||||||||
| 9. | 详细信息 |
|
某溶液中可能含有Na+、Mg2+、Fe2+、H+、OH-、Cl-、NO3-、I-中的若干种,向该溶液中加入铝粉后,溶液中有Al3+生成,则原溶液中能大量共存的离子最多有 A.4种 B.5种 C.6种 D.7种
|
|
| 10. | 详细信息 |
|
.等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在 A.甲、乙中都是铝过量 B.甲中铝过量,乙中碱过量 C.甲中酸过量,乙中铝过量
|
|
| 11. | 详细信息 |
|
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是( ) A.Mg2+、Al3+、Fe2+ B.Mg2+、Al3+ C.H+、Ba2+、Al3+ D.H+、Mg2+、Al3+
|
|
| 12. | 详细信息 |
|
.向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是 A.在0~a范围内,只发生中和反应 B.ab段发生反应的离子方程式为CO32-+2H+ C.a=0.3 D.原混合溶液中NaOH与Na2CO3
|
|
| 13. | 详细信息 |
|
FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( ) A.溶液中一定不含Fe3+ B.溶液中一定含Fe2+ C.溶液中一定不含Cu2+ D.剩余固体中一定含Cu
|
|
| 14. | 详细信息 |
|
在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是( ) A.n≥1 B.1<n<2 C.2≤n<4 D.n≥4
|
|
| 15. | 详细信息 |
|
.120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( ) A.2.0mol/L B.1.5mol/L C.0.18mol/L D.0.24mol/L
|
|
| 16. | 详细信息 |
|
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( ) A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH
|
|
| 17. | 详细信息 |
|
.某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式 (2)物质②为 . (3)请写出FeCl3与铁粉反应的化学方程式 . (4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为 ,此过程中发生的氧化还原反应为(用化学方程式表达) . (5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是 .
|
|
| 18. | 详细信息 |
|
二氧化氯是黄绿色的气体,可用于水体消毒与废水处理.一种制备方法为: H2C2O4+ NaClO3+ H2SO4→ Na2SO4+ CO2↑+ ClO2↑+ H2O 完成下列填空: (1)配平上述反应方程式,该反应的还原产物是 . (2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O) g. (3)上述反应物中属于第三周期的元素的原子半径大小顺序是 ,其中原子半径最大的元素最外层电子云形状为 . (4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与 相同.(写一种) (5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式: . (6)上述反应产物NaCl中含有 键,工业上用电解熔融的氯化钠制备金属钠,氯气在 (写电极名称)产生.
|
|
| 19. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||
|
某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下: 第一步:配制饱和NaCl溶液,倒入烧杯中加热; 第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟; 第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干; 第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体, 已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
回答下列问题: (1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 . (2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。 (4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。 ① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒 a.使用容量瓶前检验它是否漏水 b.容量瓶用蒸馏水洗净后,再用待配溶液润洗 c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容 d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用 e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 ② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3 (%)=
|
||||||||||||||||||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
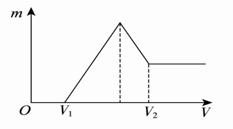
将0.1 mol的镁和铝的混合物溶于100 mL 2 mol·L-1稀硫酸中,然后滴加1 mol·L-1的NaOH溶液。请回答下列问题: (1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积的变化所示。
当V1=160 mL时,金属粉末中n(Mg)=__________mol,V2=__________。 (2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=__________。 (3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol·L-1稀硫酸溶解此混合物后,再加入450 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。写出满足此条件的a的取值范围 。
|
|