2019еұұдёңй«ҳдёҖдёӢеӯҰжңҹйІҒ科зүҲй«ҳдёӯеҢ–еӯҰејҖеӯҰиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҲйҮ‘жҳҜдёҖзұ»з”ЁйҖ”е№ҝжіӣзҡ„йҮ‘еұһжқҗж–ҷ,дёӢеҲ—е…іеҗҲйҮ‘зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺй’ўжҳҜй“Ғзҡ„дёҖз§ҚеҗҲйҮ‘пјҺBпјҺйҖҡеёёеҗҲйҮ‘зҡ„зЎ¬еәҰжҜ”дёҚдёҠзәҜеҮҖзҡ„йҮ‘еұһ CпјҺеҗҲйҮ‘жҳҜдёӨз§ҚйҮ‘еұһзҶ”еҗҲиҖҢжҲҗзҡ„е…·жңүйҮ‘еұһзү№жҖ§зҡ„зү©иҙЁ DпјҺдёҖиҲ¬ең°иҜҙеҗҲйҮ‘зҡ„зҶ”зӮ№жҜ”е®ғзҡ„еҗ„жҲҗеҲҶйҮ‘еұһзҡ„зҶ”зӮ№йғҪй«ҳ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺNa2O2жҳҜзўұжҖ§ж°§еҢ–зү©пјҢеҸҜд»ҘеҒҡжҪңж°ҙиүҮдёӯзҡ„дҫӣж°§иҚҜе“ҒгҖӮ BпјҺFe2O3дҝ—з§°й“ҒзәўпјҢеҸҜз”ЁдәҺеҲ¶дҪңзәўиүІжІ№жјҶгҖӮ CпјҺзғ§зўұе’Ңе°ҸиӢҸжү“йғҪеҸҜз”ЁдәҺжІ»з–—иғғй…ёиҝҮеӨҡ DпјҺж°ўж°§еҢ–й“Ғиғ¶дҪ“е…·жңүеҗёйҷ„жҖ§пјҢеҸҜз”ЁдәҺиҮӘжқҘж°ҙзҡ„жқҖиҸҢж¶ҲжҜ’
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жңүе…ійҮ‘еұһе…ғзҙ зү№еҫҒзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(В В В В ) AпјҺйҮ‘еұһе…ғзҙ зҡ„еҺҹеӯҗеҸӘжңүиҝҳеҺҹжҖ§пјҢе…¶йҳізҰ»еӯҗеҸӘжңүж°§еҢ–жҖ§ BпјҺйҮ‘еұһе…ғзҙ зҡ„еҚ•иҙЁеңЁеёёжё©дёӢйғҪдёәеӣәдҪ“ CпјҺйҮ‘еұһйҳізҰ»еӯҗиў«иҝҳеҺҹдёҚдёҖе®ҡеҫ—еҲ°йҮ‘еұһеҚ•иҙЁ DпјҺеҗ«йҮ‘еұһе…ғзҙ зҡ„зҰ»еӯҗйғҪжҳҜйҳізҰ»еӯҗ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
|
дёӢеҲ—зү©иҙЁеҲҶзұ»жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
|
||||||||||||||||||||||||||
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺзўій…ёй’ЎдёҺзӣҗй…ёеҸҚеә”2HпјӢпјӢBaCO3===Ba2пјӢпјӢH2OпјӢCO2вҶ‘ BпјҺж°ўж°§еҢ–й’Ўжә¶ж¶ІдёҺзЁҖзЎ«й…ёж··еҗҲBa2пјӢпјӢSO CпјҺйҮ‘еұһй’ дёҺж°ҙзҡ„еҸҚеә” NaпјӢH2O===Na+пјӢOHпјҚпјӢH2вҶ‘ D. й“ңзүҮжҸ’е…ҘзЎқ酸银жә¶ж¶ІдёӯпјҡCu + Ag+ = Cu2+ + Ag
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж“ҚдҪңдёҚиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„жҳҜ (В В В )
A.еҲҶзҰ»жұҪжІ№дёҺж°ҙB.йҷӨеҺ»Na2SO4жә¶ж¶Ідёӯзҡ„BaSO4 C.жЈҖйӘҢиЈ…зҪ®ж°”еҜҶжҖ§В В D.收йӣҶH2
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺNa2CO3е’ҢNaHCO3иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺзӯүиҙЁйҮҸзҡ„NaHCO3е’ҢNa2CO3дёҺи¶ійҮҸзҡ„зӣҗй…ёеҸҚеә”пјҢеңЁзӣёеҗҢжқЎд»¶дёӢNaHCO3дә§з”ҹCO2зҡ„дҪ“з§ҜеӨ§ BпјҺзӯүзү©иҙЁзҡ„йҮҸзҡ„NaHCO3е’ҢNa2CO3дёҺеҗҢжө“еәҰзҡ„и¶ійҮҸзӣҗй…ёеҸҚеә”пјҢNa2CO3жүҖж¶ҲиҖ—зӣҗй…ёзҡ„дҪ“з§ҜжҳҜNaHCO3зҡ„дёӨеҖҚ CпјҺеҗ‘зўій…ёй’ е’Ңзўій…ёж°ўй’ зҡ„ж°ҙжә¶ж¶ІдёӯеҲҶеҲ«ж»ҙеҠ й…ҡй…һиҜ•ж¶ІпјҢзәўиүІж·ұзҡ„дёҖе®ҡжҳҜзўій…ёй’ жә¶ж¶І DпјҺе°ҶзҹізҒ°ж°ҙеҠ е…ҘNa2CO3е’ҢNaHCO3жә¶ж¶ІдёӯпјҢйғҪдә§з”ҹзҷҪиүІжІүж·Җ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺзўұйҮ‘еұһе…ғзҙ е’ҢеҚӨж—Ҹе…ғзҙ дёҚжӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺеҚӨж—Ҹе…ғзҙ д»ҺдёҠеҲ°дёӢпјҢйқһйҮ‘еұһеўһејәпјҢе…¶еҜ№еә”зҡ„еҚ•иҙЁж°§еҢ–жҖ§йҖҗжёҗеўһејәгҖӮ BпјҺзўұйҮ‘еұһе…ғзҙ д»ҺдёҠеҲ°дёӢпјҢйҮ‘еұһжҖ§еўһејәпјҢе…¶еҜ№еә”зҡ„еҚ•иҙЁиҝҳеҺҹжҖ§йҖҗжёҗеўһејәгҖӮ CпјҺеҚӨж—Ҹе…ғзҙ д»ҺдёҠеҲ°дёӢпјҢе…¶еҜ№еә”зҡ„ж°ўеҢ–зү©зЁіе®ҡжҖ§еҮҸејұгҖӮ DпјҺзўұйҮ‘еұһе…ғзҙ е’ҢеҚӨж—Ҹе…ғзҙ еҲҶеҲ«дҪҚдәҺе‘Ёжңҹ表第1е’Ң第17зәөиЎҢ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. ж ҮеҶөдёӢпјҢ22.4 Lж°§ж°”зҡ„еҺҹеӯҗж•°дёәNA B. 1molCOе’Ң1molCO2ж··еҗҲеҗҺпјҢж°§еҺҹеӯҗж•°дёә2NA C. ж ҮеҶөдёӢ11.2Lд№ҷйҶҮжүҖеҗ«еҲҶеӯҗж•°дёә0.5NA D. еёёжё©еёёеҺӢдёӢпјҢ1.06gNa2CO3еӣәдҪ“дёӯжүҖеҗ«зҡ„Na+ж•°зӣ®дёә0.02 NA
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
WгҖҒXгҖҒYгҖҒZеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹе…ғзҙ пјҢWе…ғзҙ жңҖеӨ–еұӮз”өеӯҗж•°жҳҜеҶ…еұӮз”өеӯҗж•°зҡ„дёӨеҖҚпјҢXдёҺZеұһдәҺеҗҢдё»ж—Ҹзҡ„е…ғзҙ пјҢZ е…ғзҙ жңҖй«ҳжӯЈд»·дёҺжңҖдҪҺиҙҹд»·д№Ӣе’Ңдёә4пјӣYдёәзҹӯе‘Ёжңҹе…ғзҙ дёӯеҚҠеҫ„жңҖеӨ§зҡ„е…ғзҙ пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В (В В В ) AпјҺз®ҖеҚ•зҰ»еӯҗеҚҠеҫ„Y>XВ В В В BпјҺйқһйҮ‘еұһжҖ§W>Z CпјҺж°ўеҢ–зү©зЁіе®ҡжҖ§X>Z>WВ В В DпјҺжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§В W>Z
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж— иүІйҖҸжҳҺзҡ„зўұжҖ§жә¶ж¶ІдёӯпјҢиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜпјҲгҖҖгҖҖпјү AгҖҒ Na+гҖҒK+гҖҒCO32пјҚгҖҒNO3пјҚBгҖҒCu2+гҖҒAl3+гҖҒSO42пјҚгҖҒNO3пјҚ CгҖҒ K+гҖҒFe2+гҖҒNH4+гҖҒNO3пјҚВ В В В В В В В В В В DгҖҒNH4+гҖҒNa+гҖҒNO3пјҚгҖҒClпјҚ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
AgдёҺNaClOжә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2вҶ‘ дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ пјҲВ пјү AпјҺиҜҘеҸҚеә”еұһдәҺеӨҚеҲҶи§ЈеҸҚеә” BпјҺж°§ж°”жҳҜиҝҳеҺҹдә§зү© CпјҺеҸҚеә”дёӯ银еҒҡж°§еҢ–еүӮ DпјҺиӢҘз”ҹжҲҗ2.24LпјҲж ҮеҮҶзҠ¶еҶөпјүO2пјҢеҸҚеә”дёӯиҪ¬з§»зҡ„з”өеӯҗ0.08mol
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
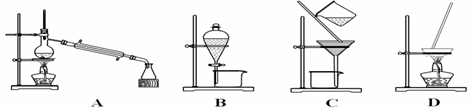
|
дёӢеҲ—е®һйӘҢж“ҚдҪңпјҢе®һйӘҢзҺ°иұЎе’Ңе®һйӘҢз»“и®әйғҪжӯЈзЎ®зҡ„жҳҜ
|
|||||||||||||||||||||
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҝҮзЁӢйңҖиҰҒеҠ иҝҳеҺҹеүӮе®һзҺ°зҡ„жҳҜпјҲВ В В пјү В AпјҺFe2+вҶ’Fe3+В В В В BпјҺH2O2вҶ’ O2CпјҺCl2 вҶ’2ClпјҚгҖҖгҖҖDпјҺCO2 вҶ’CO32-
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
пјҲ1пјүAгҖҒBгҖҒCгҖҒDдёәдёӯеӯҰеёёи§Ғзҡ„ж··еҗҲзү©еҲҶзҰ»жҲ–жҸҗзәҜзҡ„еҹәжң¬иЈ…зҪ®пјҢиҜ·еӣһзӯ”пјҡ в‘ еҲҶзҰ»жӨҚзү©жІ№е’Ңж°ҙпјҢйҖүжӢ©иЈ…зҪ®пјҲеЎ«еәҸеҸ·пјүпјҢдё»иҰҒдҪҝз”Ёд»ӘеҷЁеҗҚз§°пјӣ в‘ЎеҲҶзҰ»д№ҷдәҢйҶҮе’ҢдёҷдёүйҶҮзҡ„ж··еҗҲжә¶ж¶ІпјҢйҖүжӢ©иЈ…зҪ®пјҲеЎ«еәҸеҸ·пјү
пјҲ2пјүе®һйӘҢе®ӨйңҖй…ҚеҲ¶250mL0.1molВ·L-1зҡ„Na2CO3жә¶ж¶ІпјҢеЎ«з©ә并еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ й…ҚеҲ¶250mL0.1molВ·L-1зҡ„Na2CO3жә¶ж¶ІпјҢе®һйҷ…еә”з§°еҸ–Na2CO3зҡ„иҙЁйҮҸжҳҜgпјҢе®һйӘҢиҝҮзЁӢдёӯжүҖйңҖзҡ„зҺ»з’ғд»ӘеҷЁжңүгҖӮ в‘ЎиӢҘеңЁжә¶ж¶Ій…ҚеҲ¶иҝҮзЁӢдёӯеҮәзҺ°еҰӮдёӢжғ…еҶөпјҢеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰе°ҶжңүдҪ•еҪұе“ҚпјҲеЎ«вҖңеҒҸй«ҳвҖқвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјү иӢҘе®№йҮҸ瓶дёӯжңүе°‘йҮҸи’ёйҰҸж°ҙВ В В В В В В В В пјӣиӢҘе®ҡе®№ж—¶дҝҜи§ҶеҲ»еәҰзәҝВ В В В В В В В В гҖӮ пјҲ3пјүз„ҰзӮӯдёҺжө“зЎ«й…ёеҠ зғӯжқЎд»¶дёӢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ В C + 2H2 SO4пјҲжө“пјү= 2SO2вҶ‘+ CO2вҶ‘ + 2H2O еҪ“еҸҚеә”дёӯиҪ¬з§»2moleвҖ”ж—¶пјҢз”ҹжҲҗSO2зҡ„дҪ“з§ҜпјҲж ҮеҮҶзҠ¶еҶөпјүжҳҜL
|
||||||||||||||||
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
й“ҒеҸҠе…¶еҢ–еҗҲзү©[еҰӮFeCl3,Fe(OH)3,Na2FeO4зӯү]еңЁз”ҹдә§гҖҒз”ҹжҙ»дёӯеә”з”Ёе№ҝжіӣпјҢиҜ·з»“еҗҲжүҖеӯҰзҹҘиҜҶпјҢеӣһзӯ”й—®йўҳпјҡ пјҲ1пјүз”өеӯҗе·ҘдёҡйңҖз”Ё30%зҡ„FeCl3жә¶ж¶Іи…җиҡҖж•·еңЁз»қзјҳжқҝдёҠзҡ„й“ңз®”пјҢеҲ¶йҖ еҚ°еҲ·з”өи·ҜжқҝпјҢжЈҖйӘҢFeCl3жә¶ж¶ІдёӯFe3+еӯҳеңЁзҡ„еёёз”ЁиҜ•еүӮжҳҜгҖӮFeCl3жә¶ж¶Іи…җиҡҖж•·еңЁз»қзјҳжқҝдёҠзҡ„й“ңз®”еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә ж¬Ід»Һи…җиҡҖеҗҺзҡ„еәҹж¶Ідёӯеӣһ收Cu并йҮҚж–°иҺ·еҫ—FeCl3жә¶ж¶ІпјҢзҺ°жңүдёӢеҲ—иҜ•еүӮв‘ ж°Ҝж°”в‘Ўй“ҒзІүв‘ўжө“зЎ«й…ё в‘Јзӣҗй…ёв‘Өзғ§зўұв‘Ҙж°Ёж°ҙиҜ·йҖүжӢ©иҜ•еүӮеҶҷеҮәеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ еәҹж¶Ідёӯеӣһ收Cuпјҡ еәҹж¶ІйҮҚж–°иҺ·еҫ—FeCl3жә¶ж¶Іпјҡ пјҲ2пјүжІёж°ҙдёӯйҖҗж»ҙеҠ е…Ҙ1mol/L FeCl3жә¶ж¶ІпјҢ继з»ӯеҠ зғӯиҮіжә¶ж¶Іе‘ҲйҖҸжҳҺзҡ„зәўиӨҗиүІпјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҢиҜҘеҲҶж•Јзі»дёӯеҲҶж•ЈиҙЁзҡ„еҫ®зІ’зӣҙеҫ„дёәnm (3)й«ҳй“Ғй…ёй’ Na2FeO4жҳҜдёҖз§Қж–°еһӢеҮҖж°ҙеүӮпјҢеҸҜд»ҘйҖҡиҝҮеҰӮдёӢеҸҚеә”еҲ¶еҫ— 2 Fe(OH)3+ 3NaClO+ 4NaOH = 2Na2FeO4 + 3X +5H2OВ X зҡ„еҢ–еӯҰејҸдёәпјҢ д»ҺеҢ–еҗҲд»·еҚҮйҷҚи§’еәҰиҖғиҷ‘пјҢй«ҳй“Ғй…ёй’ иғҪеӨҹжқҖиҸҢжҳҜеӣ дёәе®ғе…·жңү жҖ§
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
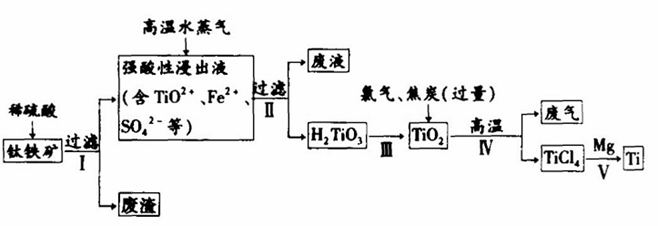
йҮ‘еұһй’ӣпјҲTiпјүзҡ„жңәжў°ејәеәҰй«ҳпјҢжҠ—иҡҖиғҪеҠӣејәпјҢжңүвҖңжңӘжқҘйҮ‘еұһвҖқд№Ӣз§°гҖӮе·ҘдёҡдёҠеёёз”ЁзЎ«й…ёжөёй’ӣй“Ғзҹҝ(е…¶дё»иҰҒжҲҗеҲҶдёәй’ӣй…ёдәҡй“ҒпјҲFeTiO 3е®ғйҡҫжә¶дәҺж°ҙпјҢдҪҶиғҪдёҺй…ёеҸҚеә”пјүзҡ„ж–№жі•еҲ¶еҸ–дәҢж°§еҢ–й’ӣ пјҢеҶҚз”ұдәҢж°§еҢ–й’ӣ еҲ¶еҸ–йҮ‘еұһй’ӣгҖӮе·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳ (1) FeTiO3дёӯй’ӣе…ғзҙ зҡ„еҢ–еҗҲд»·дёә (2)зЁҖзЎ«й…ёдёҺFeTiO3еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡ
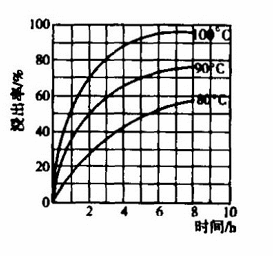
(4)еҶҷеҮәиҝҮзЁӢIVзҡ„еҢ–еӯҰж–№зЁӢејҸпјҲжіЁж„Ҹз„ҰзӮӯиҝҮйҮҸпјү (5)й…ёжөёдёӯпјҢй“Ғзҡ„жөёеҮәзҺҮдёҺж—¶й—ҙгҖҒжё©еәҰзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҢеҰӮеӣҫеҸҜзҹҘпјҢеҪ“й“Ғзҡ„жөёеҮәзҺҮдёә70%ж—¶пјҢеҸҜйҮҮз”Ёзҡ„е®һйӘҢжқЎд»¶дёә В В В В
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||
|
дёӢеӣҫдёәе‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢе…ғзҙ в‘ пҪһв‘ЁеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®еҰӮдёӢпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүиЎЁдёӯеҢ–еӯҰжҖ§иҙЁжңҖзЁіе®ҡзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјӣ пјҲ2пјүйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјӣ пјҲ3пјүе…ғзҙ ⑧зҡ„е…ғзҙ з¬ҰеҸ·дёәпјҢеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜпјӣ пјҲ4пјүе…ғзҙ в‘ўзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©дёӯеҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢдёә пјҲ5пјүжҜ”иҫғе…ғзҙ в‘ӨгҖҒв‘Ҙзҡ„з®ҖеҚ•ж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§пјҲз”ЁеҢ–еӯҰејҸиЎЁзӨәпјүпјӣ В жҜ”иҫғе…ғзҙ в‘ӨгҖҒв‘Ҙзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§ејәејұпјҲз”ЁеҢ–еӯҰејҸиЎЁзӨәпјүпјӣ пјҲ6пјүи®ҫи®Ўе®һйӘҢжҜ”иҫғе…ғзҙ в‘ҘгҖҒ⑧зҡ„йқһйҮ‘еұһжҖ§ејәејұ
|
|||||||||||||||||||||||||||||||||||||
- жІіеҢ—2018е№ҙй«ҳдәҢдёҠеҶҢеҢ–еӯҰжңҲиҖғжөӢйӘҢеёҰзӯ”жЎҲдёҺи§Јжһҗ
- 2019-2020е№ҙй«ҳдәҢдёҠеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰпјҲзҰҸе»әзңҒжјіе·һеёӮе№іе’ҢеҺҝ第дёҖдёӯеӯҰпјү
- й•Үжұҹеҝғж№–й«ҳзә§дёӯеӯҰй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- еҗҲиӮҘеёӮ2019е№ҙй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- жөҷжұҹзңҒж…ҲжәӘеёӮ2020-2021е№ҙй«ҳдәҢдёҠеӯҰжңҹжңҹжң«жөӢиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еҢ—дә¬2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•еңЁзәҝзӯ”йўҳ
- жұҹиӢҸзңҒйӮ—жұҹдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·еңЁзәҝжЈҖжөӢ
- еҶіиғңй«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ жЁЎжӢҹиҖғиҜ•з»ғд№