2020河南高二上学期人教版(2019)高中化学单元测试
| 1. | 详细信息 |
|
已知:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1 L 1 mol·L-1的NaOH溶液恰好完全反应,其中放热最少的是( ) A.稀盐酸 B.浓硫酸 C.稀醋酸 D.稀盐酸和稀醋酸
|
|
| 2. | 详细信息 |
|
下列说法正确的是( ) A.1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 B.已知2CO2(g)=2CO(g)+O2(g)△H=+566 kJ/mol ,则CO的燃烧热ΔH =-283.0kJ/mol C.H2SO4与Ba(OH)2反应生成1molH2O时放出的热叫做中和热 D.已知H+(aq)+OH–(aq)=H2O(1) △H = -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3kJ
|
|
| 3. | 详细信息 |
|
1molH-H键的键能是436 kJ/mol,1mol I-I键的键能是151kJ/mol,1mol H-I 的键能是299 kJ/mol,则对于H2(g)+I2 A.放出11kJ热量 B.吸收11kJ热量 C.放出288kJ热量 D.吸收288kJ热量
|
|
| 4. | 详细信息 |
|
化学反应
A.该反应是吸热反应 B.断裂 C.断裂2 mol AB中的化学键需要吸收y kJ的能量 D.2 mol AB的总能量高于
|
|
| 5. | 详细信息 |
|
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A.该反应的化学方程式为: 3Z = 3X+2Y B.t0时,X、Y、Z的质量不再改变 C.t0时,Z的浓度为1.2 mol/L D.t0时,反应停止,反应速率为0
|
|
| 6. | 详细信息 |
|
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) A.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 B.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 C.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
|
|
| 7. | 详细信息 |
|
一定温度下,在容积不变的密闭容器中,反应I2(g) + H2(g) A.v正(I2)=2v逆(HI) B.容器中气体的压强不再改变,气体的密度和摩尔质量不再改变 C.I2、H2、HI的分子数之比为1∶1∶2; D.容器内气体的颜色不再发生改变
|
|
| 8. | 详细信息 | |||||||||||||||
|
下列操作能达到实验目的的是
A.A B.B C.C D.D
|
||||||||||||||||
| 9. | 详细信息 |
|
某温度下反应N2O4(g) A.加压时(体积变小),将使正反应速率增大 B.保持体积不变,加入少许NO2,将使正反应速率减小 C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 D.保持体积不变,通入He,再达平衡时颜色不变
|
|
| 10. | 详细信息 |
|
下列有关说法正确的是( ) A.SO2(g)+H2O(g)===H2SO3(l),该过程熵值增大 B.SO2(g) ===S(s)+O2(g) ΔH>0,ΔS<0该反应能自发进行 C.SO2(g)+2H2S(g)===3S(s)+2H2O(l) ,该过程熵值增大 D.Ba(OH)2(s)+2NH4Cl(s)===2BaCl2(s)+2NH3(g)+2H2O(l),ΔH<0,此反应一定能自发
|
|
| 11. | 详细信息 |
|
下列说法正确的是( ) A.pH=7的溶液一定呈中性 B.pH=3的盐酸的c(H+)是pH=1 的盐酸的100倍 C.Na2CO3溶液与NaHCO3 溶液中所含微粒的种类一定相同 D.同浓度同体积的氨水与NaOH溶液,与相同浓度的盐酸反应呈中性时,消耗盐酸的体积相同
|
|
| 12. | 详细信息 |
|
常温下,下列关于 A.该溶液中由 B.与等体积 C.该溶液中离子浓度大小关系: D.滴加
|
|
| 13. | 详细信息 |
|
.下列关于氢氧化钠溶液和氨水的说法正确的是( ) A.分别中和等物质的量浓度、等体积的两溶液,所需HCl的物质的量相等 B.物质的浓度相等的两溶液具有相等的pH C.pH相等的两溶液稀释相同倍数,pH增大幅度不相等 D.物质的量浓度相等的两溶液,分别通入HCl气体反应后呈中性的溶液中(忽略溶液体积变化)c(Na+)=c(NH4+)
|
|
| 14. | 详细信息 |
|
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确
A.t°C时,Ag2CrO4的Ksp为1×10-8 B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等 D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
|
|
| 15. | 详细信息 |
|
下列化学方程式书写错误的是( ) A.NaHCO3水解的离子方程式:HCO3-+ H2O B.NH4Cl水解的化学方程式:NH4Cl+H2O C.Al(OH)3的两性电离方程式:H++AlO2-+H2O D.NaHSO3的电离方程式:NaHSO3=Na++HSO3-
|
|
| 16. | 详细信息 |
|
关于 A.加入盐酸,抑制 C.浓度越大,
|
|
| 17. | 详细信息 |
|
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1 D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
|
|
| 18. | 详细信息 |
|
已知:2H2(g)+ O2(g)===2H2O(l) ΔH1=-572 kJ·mol-1 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1 现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( ) A.1∶2 B.1∶3 C.1∶4 D.2∶3
|
|
| 19. | 详细信息 | ||||||||||||||||||
|
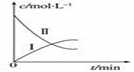
某实验探究小组研究320 K时N2O5的分解反应:2N2O5
A.曲线Ⅰ是N2O5的浓度变化曲线 B.曲线Ⅱ是O2的浓度变化曲线 C.N2O5的浓度越大,反应速率越快 D.升高温度对该反应速率无影响
|
|||||||||||||||||||
| 20. | 详细信息 |
|
25℃时,醋酸溶液中存在电离平衡:CH3COOH A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降 B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小 C.加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大 D.升高体系温度(忽略醋酸挥发),溶液中H+数目增多,平衡一定向左移动
|
|
| 21. | 详细信息 |
|
一定温度下,反应3Fe(s)+4H2O(g) (1)增加Fe的物质的量,其正反应速率___________。(A.变快 B.不变 C变慢,前4问填字母代号)。 (2)将容器的体积缩小一半,其正反应速率___________ ,逆反应速率___________。 (3)若保持体积不变,充入Ar,其逆反应速率___________ (4)保持压强不变,充入Ar,其正反应速率 ___________。 (5)保持压强不变,充入Ar,该反应向___________ 方向移动。(填正移、逆移或不移)
|
|
| 22. | 详细信息 | ||||||||||
|
(1)工业上氨气的催化氧化反应的化学方程式_____________ (2)偏铝酸钠溶液中通入过量二氧化碳的离子方程式_____________; (3)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g) = CF4(g)+4HF(g) ΔH =-1940 kJ·mol-1,计算H—F键的键能为______________。
(4)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和一种还原性的气体,放出热量4.28kJ,写出该反应的热化学方程式_________________。
|
|||||||||||
| 23. | 详细信息 |
|
(1)25℃时,0.005mol/LH2SO4溶液的pH=______ ,0.001mol/LNaOH溶液的pH=______ 。 (2)某温度下纯水的c(H+)=2.0×10-7mol/L,则此溶液中的c(OH-)=_______;若温度不变,滴入稀盐酸,使c(H+)=5.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=_________。
|
|
| 24. | 详细信息 |
|
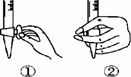
葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。 (1)滴定前排气泡时,应选择下图中的________(填序号)。
(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积______(填序号)。 ①=10 mL ②=40 mL ③<10 mL ④>40 mL。 (3)上述滴定实验中,可选择_______为指示剂,选择该指示剂时如何判断反应到达滴定终点:______ (4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
|
|