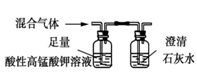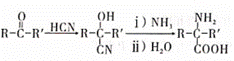2019辽宁高三下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
化学与生活、生产和社会可持续发展密切相关。下列说法正确的是 A.高纯二氧化硅可用作计算机芯片的材料 B.硅胶、铁粉均可作为食品包装中的抗氧化剂 C.氯化铝是工业上电解法治炼金属铝的原料 D.“地沟油”可用来制肥皂和生物柴油
|
|
| 2. | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是 A.常温常压下,36g 18O2中所含的中子数为16NA B.8.0g Cu2S和CuO的混合物中含有的铜原子数为0.1NA C.电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA D.室温下向1L pH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA
|
|
| 3. | 详细信息 |
|
下列实验方案正确且能达到实验目的的是 A. B. C. D.
|
|
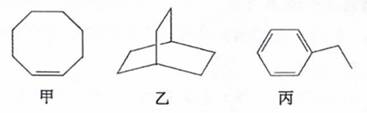
| 4. | 详细信息 |
|
甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
A.甲、乙的化学式均为C8H14 B.乙的二氯代物共有7种(不考虑立体异构) C.丙的名称为乙苯,其分子中所有碳原子可能共平面 D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
|
|
| 5. | 详细信息 |
|
W、X、Y、Z均为短周期元素且原子序数依次增大,W和X形成的气态化合物的水溶液显碱性,Y的M层电子数与K层电子数之和为L层电子数的一半,Z的低价氧化物和其气态氢化物可以反应得到 Z的淡黄色单质。下列说法正确的是 A.Y与Z的单质混合加热能反应 B.X、Y、Z的简单离子半径:X<Y<Z C.Z的含氧酸酸性强于X的含氧酸 D.单质的还原性:W>Y
|
|
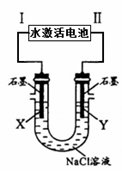
| 6. | 详细信息 |
|
Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是
A.II为正极,其反应式为Ag++e−=Ag B.水激活电池内Cl–由正极向负极迁移 C.每转移1mol e−,U型管中消耗0.5mol H2O D.开始时U型管中Y极附近pH逐渐增大
|
|
| 7. | 详细信息 |
|
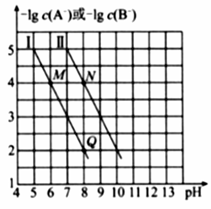
已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1mol·L−1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A−、B−的物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
下列说法正确的是 A.曲线Ⅰ表示溶液的pH与-lgc(A−)的变化关系 B. C.溶液中水的电离程度:M>N D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
|
|
| 8. | 详细信息 |
|
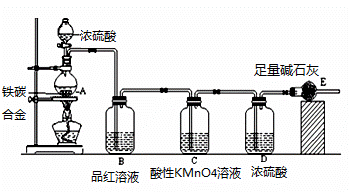
某校化学趣小组设计了图示实验装置来测定某铁碳合金的质量分数。
完成下列填空: (1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②______________________________________。 (2)加热时A中碳与浓硫酸反应的化学方程式为____________,B中的现象是__________;C的作用是______________________________。 (3)待A中不再逸出气体时,停止加热,拆下E并称重,E称重b g。则铁碳合金中铁的质量分数的表达式为______________________________(化简后的表达式)。 (4)甲同学认为利用此装置测得铁的质量分数偏大,可能的原因是__________________。 (5)乙同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量质量分数测量值偏低是___________(回答一条即可)。
|
|
| 9. | 详细信息 |
|
碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________。 (2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________。 (3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。 ①写出“调铁”工序中发生反应的离子方程式:______________________、___ ____。 ②若测得滤液的成分为c(Mn2+)+c( (4)在“氧化”工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________。 (5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________。
|
|
| 10. | 详细信息 |
|
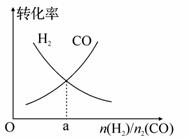
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下: ①CO(g)+2H2(g) ②2CH3OH(g) 回答下列问题: (1)已知:H2O(1)=H2O(g) ΔH=+44.0kJ/mol,若由合成气(CO、H2)制备1mol CH3OCH3(g),且生成H2O(1),其热化学方程式为_______________。 (2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6mol H2,5min达到平衡,平衡时测得c(H2)=1.8mol·L−1,c(CH3OCH3)=0.2mol·L−1,此时CO的转化率为__________。用CH3OH表示反应①的速率是_____________mol·L−1·min−1,可逆反应②的平衡常数K2=__________。 (3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是____。 A.平衡向正反应方向移动 B.平衡移动的原因是升高了温度 C.达到新平衡后体系的压强不变 D.容器中CH3OCH3的体积分数减小 (4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a=________ (填数值)。
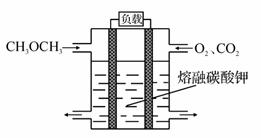
(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为熔融态的碳酸盐(如熔融K2CO3),其中CO2会参与电极反应。工作时正极的电极反应为______________ 。
|
|
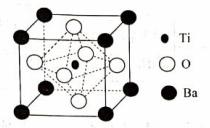
| 11. | 详细信息 |
|
【化学——选修3:物质的结构与性质】(15分) BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。 (1)基态Ti原子的价电子排布式为___________,属于___________区元素。 (2)KH2PO4晶体中存在的作用力有___________(选填字母)。 A.离子键 B.共价键 C.氢键 (3)NO (4)BaTiO3的晶胞如下图所示:
Ti原子的配位数为___________,晶体的密度为ρ g/cm3,最近的Ba原子和O原子之间的距离为___________(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
|
|
| 12. | 详细信息 |
|
【化学——选修5:有机化学基础】(15分) 某有机反应中间体(X)的一种合成路线如图所示。
已知: Ⅰ. Ⅱ.G的相对分子质量为118,可由NCCH2CH2CN水解制得。 回答下列问题: (1)A的化学名称为___________。 (2)反应②所需试剂、条件分别为____________、___________。 (3)G的分子式为_________________。 (4)X中含氧官能团的名称是_____________。 (5)反应④的化学方程式为____________。 (6)写出符合下列条件的F的所有同分异构体的结构简式____________(不考虑立体异构)。 a.苯环上连有-NO2 b.核磁共振氢谱有三组峰,且峰面积之比为6∶3∶2 (7)结合已有知识和相关信息,写出以CH3CHO为原料合成
|
|
 :
: :
: