天津2019年高三化学下册高考模拟免费试卷完整版
| 1. | 详细信息 |
|
化学与生产、生活、社会密切相关,下列说法不正确的是 A. 电动汽车充电、放电过程均有电子转移 B. 很多鲜花和水果的香味来自于酯 C. 淘米水能产生丁达尔效应,这种淘米水具有胶体的性质 D. 碳纳米管是一种比表面积大的有机合成纤维,可用作新型储氢材料 |
|
| 2. | 详细信息 |
|
下列过程没有明显现象的是 A. 加热NH4Cl固体 B. 向Al2(SO4)3溶液中滴加氨水 C. 向FeSO4溶液中通入NO2 D. 向稀Na2CO3溶液中滴加少量盐酸 |
|
| 3. | 详细信息 |
下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是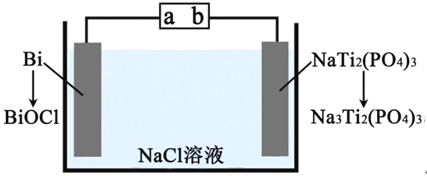 A. 充电时,a为电源正极 B. 充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)2电极移动 C. 充电时,新增入电极中的物质:n(Na+):n(Cl-)=1:3 D. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O |
|
| 4. | 详细信息 | ||||||||||||||||||||
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
|
|||||||||||||||||||||
| 5. | 详细信息 |
一定条件下,在水溶液中1 mol  A. 上述离子中结合 B. 上述离子中最稳定的是A C. 上述离子与 D. |
|
| 6. | 详细信息 |
MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰: 下列说法错误的是 A. 装置I烧瓶中放入的药品X为铜屑 B. 装置II中用“多孔球泡”可增大SO2的吸收速率 C. 装置III用于吸收未反应的SO2 D. 用装置II反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥的过程 |
|
| 7. | 详细信息 |
21世纪是海洋开发与利用的世纪。海水资源的开发利用具有十分广阔的前景。海水开发利用的流程图如下: 回答下列问题: (1)精盐中非金属离子的核外电子排布式_________________________________ (2)A常温下为气体,A的电子式是_________________________________ (3)反应①中两种氢化物稳定性比较______________>__________________填化学式) (4)反应①③是侯氏制碱反应,反应中可循环使用的物质是__________________填化学式) (5)写出侯氏制碱反应①的化学反应方程式_________________________________ (6)在空气中直接加热 (7)将406 (8)除去粗盐中 a.NaOH溶液 b.稀硫酸 c. |
|
| 8. | 详细信息 |
溴丙胺太林片是一种用于治疗胃肠痉挛性疼痛的药物,其合成路线如下: 回答下列问题: (1)A→B的反应类型___________反应;F→G的反应类型________反应。 (2)C含有的官能团名称______________________________________。 (3)C→D的化学反应方程式___________________________________。 (4)E→F的化学反应方程式_____________________________________。 (5)I的结构简式是_____________________________________________。 (6)假设有机物J苯环上的氢化学环境相同,则J核磁共振氢谱有______组峰。 (7)写出1种与NaOH物质的量比1:3发生反应的E的同分异构体的结构简式____________。 (8)将下列合成路线补充完整  该路线中化合物X为______________;化合物Y为:___________________;试剂与条件a为:__________________、__________________。 |
|
| 9. | 详细信息 |
|
磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的三种方法。回答下列问题: I.直接法  (1)气体X为___________(填化学式); (2)“浸取”步骤,浓硫酸能与KCl能发生化学反应的原因是___________________; (3)“转化”步骤发生反应的离子反应方程式_______________(已知:Ca3(PO4)2难溶于水); (4)滤液①中加入甲醇的作用是__________________________; (5)“操作I”是___________________________________; II.中和反应法 (6)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。写出此反应的离子反应方程式_______________________________;由下图判断制备磷酸二氢钾(达80%)的最佳pH范围______________________;  Ⅲ.电解法制取KH2PO4的原理如上图所示。一定条件下,还可得到NaClO3。 (7)在_____室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式______________。 |
|
| 10. | 详细信息 |
|
直接排放SO2、NO2会危害环境。工业上常采用化学方法控制污染。 (1)下图是1mol CH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。 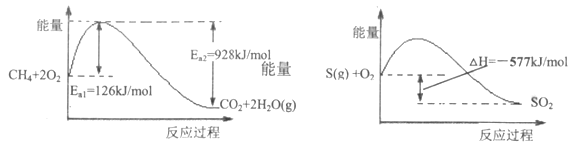 ①CH4完全燃烧的活化能是_____________kJ/mol ②在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式_____________________________; (2)为减少SO2排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收 a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3·H2O (3)对NO2+SO2  ①能够加快该化学反应速率的外界条件是___________________ a.降低温度 b.增大压强 c.升高温度 d.减小压强 ②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是___________; ③若A点对应实验中,SO2(g)的起始浓度为c0mol/L,经过 ④图中C、D两点对应的实验温度分别为 |
|
高中化学 试卷推荐
- 高中化学人教版 必修1 第三章 金属及其化合物 3.用途广泛的金属材料 用途广泛的金属材料
- 2017-2018年高一上学期期中考试化学考试题(湖南省衡阳县四中)
- 2017-2018年高一上学期第二次月考化学考卷带参考答案和解析(贵州省遵义市第四中学)
- 2017-2018年高二12月月考化学试卷(山东省寿光市第一中学)
- 2018年至2019年高二上学期第一次月考化学试卷带参考答案和解析(宁夏回族自治区育才中学)
- 2017-2018年高一12月月考化学试卷(江苏省泰州中学)
- 高中化学人教版 选修三 第2章 分子结构与性质 键参数--键能、键长与键角
- 邻水实验学校高一化学月考测验(2019年上期)免费试卷完整版
最近更新



