2017甘肃高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学与生活、生产密切相关,下列说法正确的是( ) A. 制作宇航员航天服的聚酯纤维不属于新型无机非金属材料 B. C. PM2.5是指粒径在2.5微米以下的颗粒物, D. 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰
|
|
| 2. | 详细信息 |
|
下列物质中,既有离子键,又有共价键的是( ) A. HCl B. NH4NO3 C. KCl D. CaCl2
|
|
| 3. | 详细信息 |
|
下列过程中,需吸收能量的是( ) A. H+H→H2 B. 天然气燃烧 C. I2→I+I D. S+O2→SO2
|
|
| 4. | 详细信息 |
|
2017年5月9日发布了113号Nh、115号Mc、117号Ts、118号Og这4种新元素的中文名称,下列有关说法正确的是( ) A. 115号元素在周期表中的位置是第七周期VB B. 这四种元素都是主族元素 C. 118号元素在通常情况下呈气态,其余三种为固态 D. 117号元素Ts位于金属非金属分界线上,可能是半导体,与它同族的上一
|
|
| 5. | 详细信息 |
|
既能使石蕊试液变红,又能使品红试液变为无色,还能使溴水褪色的是( ) A. Cl2 B. H2S C. SO2 D. CO
|
|
| 6. | 详细信息 |
|
下列各组中两种微粒所含电子数不相等的是( ) A. H3O+和OH-
|
|
| 7. | 详细信息 |
|
某温度下,在一恒容密闭容器中进行可逆反应:X(g)+Y(g) A. 平衡后加入少量W, B. 平衡后升温,只有吸热反应速率加快 C. 当容器中混合气体的压强不再变化时,反应达到平衡 D. 平衡后加入W,平衡未被破坏
|
|
| 8. | 详细信息 |
|
下列说法或做法错误的是( ) ①将SO2通入KMnO4酸性溶液中证明SO2的水溶液具有漂白性 ②二氧化硫的排放 ③某无色溶液中加Ba(NO3)2溶液有白色沉淀生成,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- ④稀释浓硫酸,将蒸馏水沿烧杯内壁慢慢注入盛浓硫酸的烧杯中,并用玻璃棒不断搅拌,使产生的热量不断散失 ⑤SO2使溴水褪色后,将褪色溶液加热,溶液重新 A. 全部 B. ①②③ C. ②③④ D. ②④⑤
|
|
| 9. | 详细信息 |
|
韩国三星公司因为手机电 A. N极为电源负极,联氨从c口通入 B. 负极上每消耗lmol N2H4,转移6mol电子 C. 正极的电极反应式为:O2+2H2O+ D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
|
|
| 10. | 详细信息 |
|
已知4NH3 + 5O2 = 4NO + 6H2O,若反应速率分别是ν(NH3)、ν(O2)、ν(NO)、ν(H2O气)(单位:mol•L-1•min-1)。下列关系正确的是 ( ) A. 4/5ν(NH3)=ν(O2) B. 5/6ν(O2)=ν(H2O) C. 2/3ν(NH3)=ν(H2O) D. 4/5ν(O2)=ν(NO)
|
|
| 11. | 详细信息 |
|
学科学需要借助化学专业语言来描述,下列有关化学用语正确的是( ) A.甲烷分子的比例模型: B.NH4I的电子式: C.F的结构示意图 D.中子数为20的氯原子:
|
|
| 12. | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A. 1molCH4分子中共价键总数为4NA B. 18 g D2O中含有的质子数目为10NA C. 标准状况下,5.6 LCCl4含有的分子数为0.25NA D. 28 g N2和1mol CH2=CH2所含电子数都是14NA
|
|
| 13. | 详细信息 |
|
.催化氧化的产物是 A. C.
|
|
| 14. | 详细信息 |
|
下列说法不正确的是 ( ) A. 麦芽糖及其水解产物均能发生银镜反应 B. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH C. 用溴水即可鉴别2,4-已二烯和甲苯 D.蛋白质可水解生成氨基酸
|
|
| 15. | 详细信息 | ||||||||
|
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
|
|||||||||
| 16. | 详细信息 |
|
某元素的一种同位素X原子的质量数为A,含N个中子,它与2H原子组成2HmX分子,在a g 2HmX分子中含质子的物质的量是( ) A. C.
|
|
| 17. | 详细信息 |
|
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图:
可供选择的试剂:①饱和Na2CO3溶液;②饱和K2CO3溶液;③KOH溶液;④BaCl2溶液;⑤Ba(NO3)2溶液;⑥H2O2溶液;⑦KMnO4溶液(H+);⑧稀盐酸。 请根据流程图,回答相关问题: (1)试剂a应该选用______(填试剂编号),反应的离子方程式为____________。 (2)萃取操作中,可以选的试剂还可以是_________。 A. 裂化汽油 B.乙醇 C.苯 D.直馏汽油 (3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是__________。(填试剂序号) (4)调节pH的作用是___________________________________。 (5)操作①的名称是____,操作②中用到的硅酸盐仪器除酒精灯、玻璃棒外还有_______。
|
|
| 18. | 详细信息 |
|
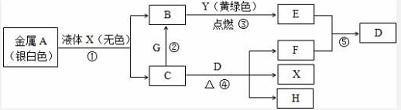
下图转化关系中,A、B、G、Y都是主族元素组成的单质,其余均是化合物。通常条件下B、E、F、Y均为气体;A、C、H焰色反应均呈黄色;E、F相遇会产生白烟。
请按要求回答下列问题: (1)化合物F的电子式_______________。 (2)G在元素周期表中位置_______________。 (3)以上反应既属于化合又属于氧化还原反应的有________________(填反应编号)。 (4)E与F反应的化学方程式为________________________________________; 加热条件下C与D的溶液反应的离子反应方程式为_______________________。 (5)G与C的溶液发生反应的离子方程式为________
|
|
| 19. | 详细信息 |
|
下表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题: (1) A到E中,属于烃的是_____(填字母);写出A与溴水反应的化学方程式___________。 (2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式_______。当n=________时,这类有机物开始出现同分异构体。 (3) B具有的性质是_____________(填 ①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤任何条件下不与氢气反应⑥可使酸性高锰酸钾溶液和溴水均褪色 (4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:_________________。 (5) C与E反应能生成相对分子质量为100的酯,其化学方程为:_____________________。
|
|
| 20. | 详细信息 |
|
11. 某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
请回答下列问题: (1)由图中数据分析:该反应的化学方程式为__________________________。 (2)反应开始至2 min,Z的平均反应速率为________。 (3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者________后者(填“大于”、“小于”或“等于”)。 (4)上述反应过程中,如果降低温度,则其反应速率________(填“增大”、“减小”或“不变)。如果使用合适的催化剂,则其反应速率________ (填“增大”、“减小”或“不变)。 (5)下列各项中不可以说明上述反应达到平衡的是________(填字母)。 a.混合气体的密度不变 b.混合气体的压强不变 c.同一物质的正反应速率等于逆反应速率 d.X的浓度保持不变 e.生成1 mol Z和同时生成1.5 mol X f.X、Y、Z的反应速率之比为3∶1∶2
|
|