2019内蒙古高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列关于“物质的量”、“摩尔质量”和“阿伏加德罗常数”等的叙述中正确的是 A.物质的量是一个基本的物理量,单位是摩尔 B.物质的摩尔质量等于其相对分子(原子)质量 C.0.12 kg 12C中所含的碳原子数为阿伏加德罗常数 D.1 mol任何物质中都含有阿伏加德罗常数个原子
|
|
| 2. | 详细信息 |
|
下列各组物质,从物质分类的角度看,后者从属于前者的一组是 A.含氧酸 酸 B.酸性氧化物 非金属氧化物 C.盐 酸式盐 D.钠盐 含钠化合物
|
|
| 3. | 详细信息 |
|
下列说法或实验操作中,正确的是 ①用托盘天平称取5.2 g NaCl ②用50 mL量筒量取5.2 mL盐酸 ③实验室制取蒸馏水时应先通冷却水再点燃酒精灯 ④区别NaCl、Na2SO4时需用到胶头滴管、试管 ⑤试管、烧杯均可用于固体加热 A.①②③ B.①③④ C.②③⑤ D.③④⑤
|
|
| 4. | 详细信息 | ||||||||||||||||||||
|
下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
|
|||||||||||||||||||||
| 5. | 详细信息 | |||||||||||||||
|
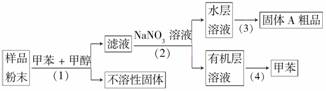
按如下方案可从样品粉末中提取具有抗肿瘤活性的天然产物A:(甲苯和甲醇为常用有机溶剂)
下列每步实验所用装置、操作正确的是
|
||||||||||||||||
| 6. | 详细信息 |
|
下列装置中,不添加其他仪器无法检查气密性的是
A B C D
|
|
| 7. | 详细信息 |
|
下列叙述正确的是 ①溶液是电中性的,胶体是带电的 ②使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 ③将饱和FeCl3溶液长时间加热,得到的一定是Fe(OH)3胶体 ④溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 ⑤江河入海口三角洲的形成通常与胶体的聚沉有关 ⑥医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关 ⑦工厂中常用的静电除尘装置是利用胶体粒子的带电性而设计的 A. ①②⑤⑥⑦ B. ①③④⑥ C. ②③⑤⑥ D. ②⑤⑦
|
|
| 8. | 详细信息 | ||||||||||||
|
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示。
由上述现象可推知a、b、c、d依次是 A.HCl、 BaCl2、AgNO3、Na2CO3 B.AgNO3、HCl、Na2CO3、BaCl2 C.BaCl2、Na2CO3、AgNO3、HCl D.AgNO3、HCl、BaCl2、Na2CO3
|
|||||||||||||
| 9. | 详细信息 |
|
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是 A.原子数目相等的三种气体,质量最大的是Z B.相同条件下,同质量的三种气体,气体密度最小的是X C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol D.同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2∶1
|
|
| 10. | 详细信息 |
|
将质量分数为p %的硫酸与等体积的水混合后得到质量分数为q%的硫酸,则下列关于p、q的关系式正确的是 A. q<p<2q B. p≤2q C. p=2q D. p>2q
|
|
| 11. | 详细信息 |
|
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是 A.w= C. ρ=
|
|
| 12. | 详细信息 |
|
某温度下,V mL不饱和NaNO3溶液a g,蒸发掉b g水或加入b g NaNO3固体(恢复到原温度)均可使溶液达到饱和,下列各量的计算结果正确的是 A.该温度下NaNO3的溶解度为50 g B.原不饱和溶液中NaNO3的质量分数为 C.原不饱和溶液中NaNO3的物质的量浓度为 D.原不饱和溶液的密度为
|
|
| 13. | 详细信息 |
|
物质发生化学变化时,下列各项在反应前后肯定不变的是 ①电子总数 ②原子总数 ③分子总数 ④物质的总质量 ⑤物质的种类 A.都不变 B.都变 C.①②④ D.③④⑤
|
|
| 14. | 详细信息 |
|
下列实验事故的处理方法正确的是 A.衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛稀盐酸的盆中 B.不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 C.较多的浓硫酸洒在实验桌上,赶紧用水冲洗 D.实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
|
|
| 15. | 详细信息 |
|
在0.5 mol Na2SO4中含有离子的个数和氧原子的质量分别为 A.1.5NA 2 mol B.1.5NA 32 g C.3.01×1023 4 mol D.1 mol 64 g
|
|
| 16. | 详细信息 |
|
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 A.0.1(b-2a)mol·L-1 B.10(2a-b)mol·L-1 C.10(b-a)mol·L-1 D.10(b-2a)mol·L-1
|
|
| 17. | 详细信息 |
|
(1)实验室制取Fe(OH)3胶体的方法是将 逐滴加在 中,继续煮沸,待溶液呈 色时停止加热,其反应的化学方程式为 (2)用 (方法)可证明胶体已制成, 用 (方法)精制胶体。 (3)20℃时,20.0mlNaCl饱和溶液质量为24.0g,将其蒸干后得NaCl固体6.00g。(计算结果保留三位有效数字) 则20℃时,NaCl饱和溶液的质量分数为 , 物质的量浓度为 ,溶解度为 。
|
|
| 18. | 详细信息 |
|
一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.4 mol NH3,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量差为17.3 g。
(1) 甲室中混合气体的物质的量_____________ mol。 (2)甲室中HCl、N2的质量之比为_______________。 (3)将隔板a去掉,当HCl与NH3充分反应生成NH4Cl固体后 (NH3+HCl===NH4Cl仅发生此反应),隔板b将位于刻度“_____”(填数字,不考虑固体物质产生的压强)处,此时体系中气体的平均相对分子质量为___________。
|
|
| 19. | 详细信息 |
|
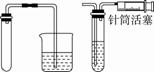
实验室需要配制0.1 mol·L-1 CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。 (1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量简、玻璃棒、________、________以及等质量的两片滤纸。 (2)计算,应选择下列________。 A.需要CuSO4固体8.0 g B.需要CuSO4·5H2O晶体12.0 g C.需要CuSO4·5H2O晶体12.5 g D.需要CuSO4固体7.7 g (3)称量。所用砝码生锈(没有脱落)则所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。 (4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________________。 (5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了___________________________________________。 (6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。 (8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______________(填“偏高”“偏低”或“无影响”)。
|
|
| 20. | 详细信息 |
|
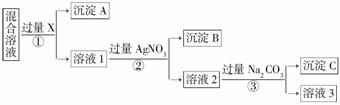
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程如图所示:
请回答下列问题: (1)上述实验流程中加入过量的Na2CO3的目的是_______________________________________________________________。 (2)按此实验方案得到的溶液3中肯定含有____________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_____________,之后若要获得固体NaNO3需进行的实验操作是___________________(填操作名称)。 (3)下列是某学生设计NaCl、Na2SO4、NaNO3混合物中Cl-、SO ①首先检验________离子,应先加入过量的________,检验是否加入过量的方法是_______________________________________________________。 ②将所得混合物________(填操作名称),然后在溶液中加入试剂________检验另一离子。
|
|
| 21. | 详细信息 | ||||||||||||
|
某同学取不同质量的镁铝合金样品分别与30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
通过计算求(写出化学反应方程式及计算推导过程):
|
|||||||||||||