夯基提能高三化学上册专题练习题带答案和解析
| 1. 选择题 | 详细信息 |
|
下列叙述不正确的是( ) A.0.1mol⋅L-1NaOH溶液与0.2mol⋅L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.1mol⋅L-1 B.常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ D.25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=13 |
|
| 2. 选择题 | 详细信息 |
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol⋅L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图,下列分析正确的是( )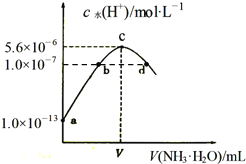 A.V=40 B.c点所示溶液中:c(H+)-c(OH-)=2c(NH3⋅H2O) C.d点所示溶液中:c(NH4+)=2c(SO42-) D.NH3⋅H2O的电离常数K=10-4mol⋅L-1 |
|
| 3. 选择题 | 详细信息 |
某温度下,向10 mL  A. 该温度下 B. X、Y、Z三点中,Y点水的电离程度最小 C. D. 向100 mL |
|
| 4. 选择题 | 详细信息 |
|
下列说法中正确的是 ( ) A. 当溶液中存在的离子只有Cl -、OH -、NH 4+、H +时,该溶液中离子浓度大小关系可能为c(Cl -)>c(NH 4+)>c(OH -)>c(H +) B. 常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 C. 常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ D. 常温下,pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
|
| 5. 选择题 | 详细信息 |
25℃时,取浓度均为0.1 mol/L的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol/LNaOH溶液、0.1 mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )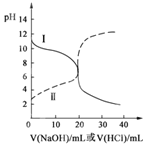 A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) B.曲线Ⅰ:滴加溶液到20 mL时: c(Cl-)>c(NH4+)>c(OH-)>c(H+) C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
|
| 6. 选择题 | 详细信息 |
|
设NA为阿伏伽德罗常数,下列说法正确的是( ) A.含0.1 molCl2的新制氯水中Cl-和ClO-粒子总数为0.2NA B.pH=1的H2SO4中含有H+数目为0.1NA C.NaH与水反应生产22.4L(标准状况)H2转移电子数为2NA D.将0.1molNH4Cl溶于稀氨水中使溶液呈中性,溶液中NH4+数目为0.1NA |
|
| 7. 选择题 | 详细信息 |
|
常温下,下列叙述正确的是( ) A.某氨水的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b-1 B.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 D.若10mLpH=a的硫酸溶液跟100mLpH=b的NaOH溶液混合后,溶液呈中性,则a+b=13 |
|
| 8. 选择题 | 详细信息 |
|
某溶液中只可能含有下列离子中的某几种:K+、NH4+、Ba2+、SO42-、I-、AlO2-。分别取样:①用pH计测试,溶液显弱酸性②加氯水和CCl4振荡后静置,下层呈无色,为确定该溶液的组成,还需检验的离子是( ) A.K+ B.SO42- C.Ba2+ D.NH4+ |
|
| 9. 选择题 | 详细信息 |
常温下,向20mL0.10mol/L的Na2CO3溶液中逐滴加入0.10mol/L 的盐酸,溶液pH的变化曲线如图所示。下列说法不正确的是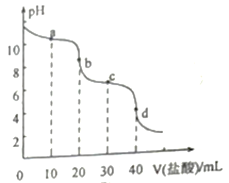 A. a点溶液中:c(HCO3-)>c(CO32-) B. b点溶液中:c(H+)-c(OH-)= c(CO32-)- c(HCO3-) C. c点溶液中: 3c(Na+)=4c(Cl-) D. d点溶液中: c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH-)+ c(Cl-) |
|
| 10. 选择题 | 详细信息 |
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是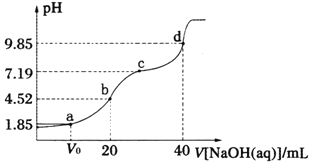 A. a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1 B. b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—) C. 对应溶液的电导率:a<b<c<d D. 对应溶液水的电离程度:a>b>c>d |
|
| 11. 选择题 | 详细信息 |
|
在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比8:1:2,则溶液中Na2SO4、NaCl、NaOH个数比为( ) A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2 |
|
| 12. 选择题 | 详细信息 |
|
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是 A. H2Y电离方程式为:H2Y+H2O B. 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) C. 常温下,酸式盐NaHY 的水溶液呈酸性 D. HY-的水解方程式为:HY-+ H2O |
|
| 13. 选择题 | 详细信息 |
|
常温下,下列溶液中各微粒浓度关系不正确的是( ) A.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>② B.向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)>c(SO42-)>c(OH-)=c(H+) C.向1L 0.1mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] D.CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
|
| 14. 选择题 | 详细信息 |
|
对于0.1mol/LNa2SO3溶液,下列叙述正确的是( ) A.c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) B.c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) C.c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
|
| 15. 选择题 | 详细信息 |
|
对常温下 A. B. 加入少量 C. 该溶液中由 D. 与等体积 |
|
| 16. 选择题 | 详细信息 |
|
含有等物质的量的CH3COOH和CH3COONa的混合溶液中,下列说法正确的是 A.c(CH3COOH) + c(H+)<c(OH-) + c(CH3COO-) B.c(H+) + c(CH3COOH) = c(OH-) + c(CH3COO-) C. c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.c(Na+) = c(CH3COOH) + c(CH3COO-) |
|
| 17. 选择题 | 详细信息 |
常温下,向1L 0.10mol/L的NaA溶被中,不断通入HCl气体(忽略溶液体积变化),得到c(A-)和c(HA)与pH的变化关系如下,则下列说法正确的是 A. 水的电离程度:X<Z B. 溶液的pH比较:X<Y<Z C. Y点时:c(Na+)=2c(A-)>c(H+)>c(OH-) D. 常温下、HA的Ka=104.75 |
|
| 18. 选择题 | 详细信息 |
|
下列溶液中有关物质的量浓度关系错误的是 A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-) B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH) D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
|
| 19. 选择题 | 详细信息 |
|
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( ) A.在0.1mol⋅L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) B.在0.1mol⋅L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) C.向0.2mol⋅L-1NaHCO3溶液中加入等体积0.1mol⋅L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol⋅L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
|
| 20. 选择题 | 详细信息 |
|
下列溶液中各微粒的浓度关系正确的是 A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-) B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S) C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
|
| 21. 选择题 | 详细信息 |
|
某电解质溶液中有有Na+、Mg2+、Cl-、SO42-,且Na+、Mg2+、Cl-的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则SO42-的物质的量浓度为( ) A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L |
|
最近更新



