2020四川高一上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列物质存放方法错误的是 A. 铝片长期放置在不密封的纸盒里 B. 漂白粉长期放置在烧杯中 C. FeSO4溶液存放在加有少量铁粉的试剂瓶中 D. 金属钠存放于煤油中
|
|
| 2. | 详细信息 |
|
下列仪器,能加热但应该垫石棉网使用的是 A.试管 B.容量瓶 C.坩埚 D.锥形瓶
|
|
| 3. | 详细信息 |
|
下列有关工业生产的叙述中正确的是 A.电解氯化钠溶液可得到金属钠 B.光照氯气和氢气的混合物生产盐酸 D.工业接触法制硫酸的主要设备有沸腾炉、接触室、吸收塔
|
|
| 4. | 详细信息 |
|
下列有关物质的性质与用途具有对应关系的是 A.MgO具有高熔点,可用于制耐火材料 B.NaHCO3受热易分解,可用于治疗胃酸过多
|
|
| 5. | 详细信息 |
|
下列实验操作错误的是 A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
|
|
| 6. | 详细信息 |
|
下列关于浊液、胶体和溶液的说法中不正确的是 A.浊液不稳定,久置易分层或沉淀 B.氢氧化铁胶体是纯净物 C.浊液、胶体、溶液的本质区别在于它们的分散质粒子直径大小不同 D.胶体可产生丁达尔效应而溶液不可以
|
|
| 7. | 详细信息 |
|
下列离子能大量共存的是 A.无色酚酞试液呈红色的溶液中:Na+ 、K+、
|
|
| 8. | 详细信息 |
|
下列反应中,离子方程式书写正确的是 A.Fe和盐酸反应:2Fe + 6H+ =2Fe3+ + 3H2↑ B.硫酸与氢氧化钡溶液反应:H++ C.醋酸和碳酸钠溶液反应:2H++ D.石灰石和盐酸反应:CaCO3 + 2H+ =Ca2+ + CO2↑ + H2O
|
|
| 9. | 详细信息 |
|
含Na2SO4、MgSO4和NaNO3的1L混合溶液,已知其中c(Mg2+)=0.4mol·L-1,c( A.0.2mol·L-1 B.0.4mol·L-1 C.0.6mol·L-1 D.0.8mol·L-1
|
|
| 10. | 详细信息 |
|
工业制备高铁酸钾的离子方程式为:2Fe(OH)3+3ClO-+4OH- A.
|
|
| 11. | 详细信息 |
|
下列有关实验现象与物质性质对应关系的说法中,错误的是 A. Na2CO3溶液遇酚酞变红,说明Na2CO3溶液呈碱性 B. Cl2使湿润的有色布条褪色,说明Cl2具有漂白性 C. NO遇空气变为红棕色,说明NO具有还原性 D. 新制的Fe(OH)2遇氧气变为红褐色,说明Fe(OH)2具有还原性
|
|
| 12. | 详细信息 |
|
下面是某同学在实验报告中的记录,其中正确的记录是 A.用25mL量筒量取18.26mL盐酸 B.用托盘天平称量9.75g硫酸铜 C.用500mL的容量瓶配制480mL溶液 D.Al (OH)3胶体带正电荷,可以产生电泳现象
|
|
| 13. | 详细信息 |
|
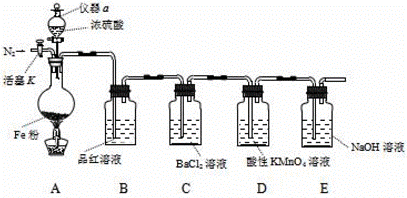
某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验)
实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。 请回答下列问题: (1)仪器a的名称是_______。实验开始前,先通一段时间N2的目的是______________。 (2)加热一段时间后发现B装置中溶液褪色,说明有_________(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是_____________。 (3)C装置中______(填“有”或“无”)沉淀生成。D中溶液紫色褪去,体现气体产物的______性(填“氧化”、“还原”或“漂白性”)。 (4)E装置的作用是_____________________。(用离子方程式表示)
|
|
| 14. | 详细信息 |
|
实验法是化学重要的研究物质性质的基本方法。某化学研究小组进行了如下实验,请回答问题。
|
|
| 15. | 详细信息 |
|
元素化合物知识是高中化学的重点内容,请你用学习到的元素化合物知识回答下列问题: (2)铜与稀HNO3反应产生NO的离子方程式为________________________,参与反应的硝酸中,表现酸性与氧化性的硝酸物质的量之比为________。铜粉放入稀硫酸溶液中,无明显变化,但加入某盐一段时间后,发现铜粉质量减少,则该盐不可能是______。(填序号) A.K2SO4 B.FeCl3 C.KNO3 D.Cu(NO3)2 (3)小苏打和Al(OH)3均可以治疗胃酸过多,小苏打治疗胃酸时发生的离子方程式为: ;Al(OH)3具有两性,也能溶解在NaOH溶液中,则反应的离子方程式为 ;AlCl3溶液与过量氨水反应制备Al(OH)3的离子方程式为 。
|
|
| 16. | 详细信息 |
|
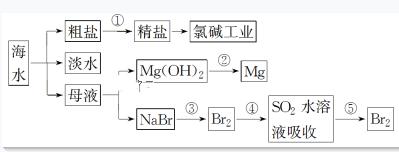
根据下流程图回答下列问题: (1)过程①是为了除去粗盐中的 (2)过程②能否一步实现转化? (填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为 。 (3)过程④反应的离子方程式为 。 (4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的 放出。
|
|