2019湖北高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
化学与工农业生产、人类生活密切相关,下列说法不正确的是( ) A.煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源 B.日常生活中可用纯碱溶液除厨房物体表面的油污 C.纽扣银锌电池体型小,含有害物质少,用后不用分类回收,可以随意处理 D.可用Na2S、H2S作沉淀剂,除废水中Cu2+、Hg2+ |
|
| 2. | 详细信息 |
|
下列判断正确的是( ) A.强电解质溶液的导电能力一定比弱电解质溶液强 B.中和等体积等物质的量浓度的盐酸和醋酸,所需氢氧化钠相同 C.如果盐酸的浓度是醋酸的浓度的两倍,则盐酸的氢离子浓度也是醋酸的两倍 D.物质的量浓度相同的磷酸溶液和磷酸钠溶液中所含磷酸根离子的物质的量相同 |
|
| 3. | 详细信息 |
|
下列关于化学反应中能量变化的说法正确的是( ) A. 化学反应中能量变化的本质原因是反应物的总能量和生成物的总能量不同 B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和在点燃条件下的△H不同 C. 在25℃、101KPa,1mol S(s)和2molS(s) 的燃烧热相等 D. 一定条件,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| 4. | 详细信息 |
|
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.8mol/(L•min); ②v(B)=0.75mol/(L•s); ③v(C)=0.6mol/(L•s); ④v(D)=0.5mol/(L•s)。该反应进行的快慢顺序为( ) A.①>②>③>④ B.③>②=④>① C.①>③>②=④ D.④>③>②>① |
|
| 5. | 详细信息 |
|
铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下: Pb(s)+PbO2(s)+2H2SO4(aq) A.充电时,PbSO4在两极上除去 B.放电时,电解质溶液的质量减少 C.放电时,PbSO4只在负极生成 D.充电时,阳极的电极反应式为:PbSO4+2H2O-2e-= PbO2+4H++SO42- |
|
| 6. | 详细信息 |
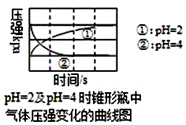
|
用压强传感器探究生铁(Fe-C)在pH=2和pH=4醋酸溶液中发生腐蚀得到的图象如图。以下结论不正确的是( ) A.曲线①表示生铁发生析氢腐蚀,Fe 被还原 B.在酸性溶液中生铁可能发生吸氧腐蚀 C.曲线②对应的容器中正极反应是O2+2H2O+4e-=4OH- D.两溶液中负极反应均为:Fe-2e-=Fe2+ |
|
| 7. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是( ) ①含有大量Fe3+的溶液:Na+、AlO2-、Cl-、SO42- ②pH=11的溶液中:CO32-、Na+、NO3-、S2-、K+ ③水电离的H+浓度为10-12mol·L-1的溶液中:NH4+、Na+、SO42-、HCO3- ④加入Mg能放出H2的溶液中:Mg2+、NO3-、NH4+、K+、SO42- ⑤PH=2的溶液中:Fe3+、NO3-、Na+、Cl-、SO42- ⑥c(H+)/c(OH-)=l×10-12的溶液中:K+、Na+、CO32-、NO3- ⑦使甲基橙变红的溶液中:Cu2+、SO42-、NH4+、NO3-、Cl- A. ①③⑤⑦ B. ①④⑤⑥ C. ②④⑤⑥ D. ②⑤⑥⑦ |
|
| 8. | 详细信息 |
|
下列有关电解质溶液的说法正确的是( ) A.向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中 B.用惰性电极电解MgCl2溶液,电解的离子方程式为: 2Cl-+2H20 C.向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1 D.将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多 |
|
| 9. | 详细信息 |
|
298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO
B.2v正(I-)=v逆(AsO C.c(AsO D.c(I-)=2ymol·L-1 |
|
| 10. | 详细信息 |
|
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g) A.该反应正反应的△H<0 B.若状态A、B的逆反应速率分别为v逆(A)、v逆(B), 则v逆(A)>v逆(B) C.在T2时,若反应体系处于状态D,则此时v正>v逆 D.若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB |
|
| 11. | 详细信息 | ||||||||||||||||||||
|
根据下列实验现象,可以得到相应结论的是( )
|
|||||||||||||||||||||
| 12. | 详细信息 |
|
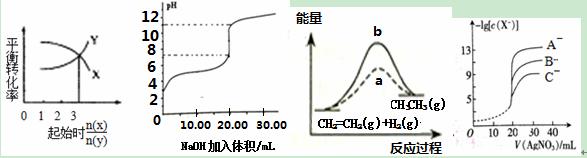
下图所示与对应叙述相符的是( )
图① 图② 图③ 图④ A.一定条件下,X和Y反应生成Z,由图①推出该反应的方程式为:X + 3Y B.图②表示用NaOH溶液滴定0.1 mol/L的某一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 C.图③中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) △H<0,使用和未使用催化剂时,反应过程中的能量变化 D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图④可确定首先沉淀的是C- |
|
| 13. | 详细信息 |
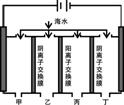
|
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知水中含Na+、Cl-等离子,电极为惰性电极。则淡水的出口为( ) A.甲 B.乙 C.丙 D.丁 |
|
| 14. | 详细信息 |
|
将少量V2O5及一定量Ag2SO4 固体置于恒容真空密闭容器,在一定温度下发生反应:Ag2SO4(s) C.若再加入少量Ag2SO4固体,则氧气的浓度不变 D.该温度下,2Ag2SO4(s) |
|
| 15. | 详细信息 |
|
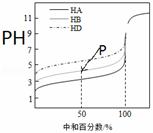
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L﹣1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( ) A.三种酸的电离常数关系:KHA>KHB>KHD B.滴定至P点时,溶液中: c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣) C.pH=7时,三种溶液中:c(A﹣)=c(B﹣)=c(D﹣) D.当中和百分数达100%时,将三种溶液混合后: c(HA)+c(HB)+c(HD)=c(OH﹣)﹣c(H+) |
|
| 16. | 详细信息 |
|
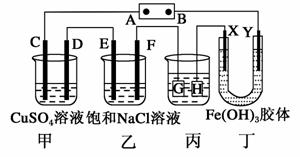
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
A.电源B极是正极 B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:1 C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 D.装置(丁)中Y极附近红褐色变深, 说明Fe(OH)3胶粒带正电荷 |
|
| 17. | 详细信息 |
|
填空(6分) (1)氢离子浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液, ①三种溶液的浓度依次为a mol·L-1,b mol·L-1,c mol·L-1,其从大到小的顺序为_________。 ②等体积的三种酸分别与NaOH溶液中和生成正盐时,消耗NaOH的物质的量依次是n1、n2、n3,其大小关系_______________。 (2)将以下几种溶液在空气中蒸干,能得到原物质的是(填序号)___________ ①MgCl2溶液 ②Na2SO3溶液 ③NaClO溶液 ④CuSO4溶液 ⑤NaAlO2溶液 (3)已知,Ksp(AgCl)=1.8×10-10, Ksp(AgBr)=5.4×10-13,现有0.1mol AgBr沉淀,每次用1L 2mol/L的NaCl溶液处理(忽略溶液体积变化),如需AgBr中的Br - 完全转到溶液中,至少需反复处理_______次。 |
|
| 18. | 详细信息 | ||||||||||||||||||
|
已知25℃时草酸(H2C2O4)的电离常数为K1=5.0×10-2,K2=5.4×10-5,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。不同温度下水的离子积常数见下表:
(1)25℃,将20 mL 0.2 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合后溶液显____ __ (选填“酸”、“碱”、“中”)性,混合后溶液中各离子浓度的由小到大的顺序为____________________; (2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,试写出反应的离子方程式:________________________________。若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,溶液颜色的变化是____________________; 若进行滴定实验时,锥形瓶中有少量蒸馏水,会使计算的结果_________(选填“偏高”、“偏低”、“无影响”) (3)90℃时,将0.005 mol/L的氢氧化钙溶液20 mL与0.0012 mol/L的草酸溶液20 mL混合,混合后溶液的pH=___________; (4)25℃时若向20 mL草酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的碳酸钾溶液10 mL,能否产生沉淀,___________(填“能”或“否”)。 |
|||||||||||||||||||
| 19. | 详细信息 |
|
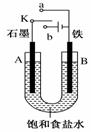
(1)某课外活动小组用如右图装置进行实验,试回答下列问题:
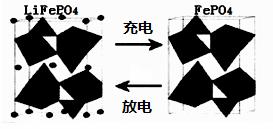
②若开始时开关K与b连接,则装置内总反应的离子方程式为_________________;根据此时的装置,判断下列说法正确的是________(填序号) a.溶液中Na+向A极移动 b.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 c.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 d.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 (2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_______________极(填“正”或“负”),该电极反应式为_______________________________________。 ②用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.1 mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_______L。 |
|
| 20. | 详细信息 |
|
在容积一定、温度一定的容器中加入一定量的A2和B2,发生如下反应: A2(?) + 2B2(g) (1)若反应过程中气体的平均相对分子质量增大,则对于A2状态判断正确的是( ) A.一定是固体 B.一定是气体 C.可能是气体,也可能是固体
①该反应为________(填“放”或“吸”)热反应,P2________P1(填“>”或“<”)。 ②在一容积可变的密闭容器中充入10mo1 A2气体和30mo1 B2气体,当达到平衡状态A时,容器容积为20L。如反应开始时仍充入10mo1 A2和30mo1 B2,则在平衡状态B时,容器容积为____________L(保留两位有效数字)。 ③若在一定温度,容积固定为VL的密闭容器中加入n molA2及2n molB2,反应达到平衡后测得平衡常数为K,此时A的转化率为x。K和x的关系满足K=_____________(化为最简表达式),在保证A2浓度不变的情况下,增大容器的体积,平衡______(填字母)。
B.向逆反应方向移动 C.不移动 ④若改变反应条件后,该反应的逆反应速率与时间的关系如右图所示,若在t2、t4时都只改变一个条件,请判断改变的条件是什么:t2时 ______________________; t4时______________________; |
|
| 21. | 详细信息 |
|
(1)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) ∆H= -354.2kJ/mol; 3Fe(s)+2O2(g)=Fe3O4(s) ∆H= -550.9kJ/mol 则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的∆H =_____ kJ·mol−1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。 (2)2018年是合成氨工业先驱哈伯(P•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) 化学吸附:N2(g)→2N*;H2(g)→2H*; 表面反应:N*+ H* 脱附:NH3* 其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答: ①利于提高合成氨平衡产率的条件有__________。 A.低温 B.高温 C.低压 D.高压 E.催化剂 ②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。 分析说明原料气中N2过量的两个理由____________________________________________; ____________________________________________________________________________。 ③关于合成氨工艺的下列理解,正确的是_______。 A.合成氨反应在不同温度下的△H和△S都小于零 B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行 D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发 |
|