2018广西高三上学期人教版高中化学高考模拟
| 1. | 详细信息 |
|
化学与生产、生活、社会密切相关,下列说法不正确的是 A. 钢铁在潮湿额定空气中放置,易发生电化学腐蚀而生锈 B. SO2、NO、NO2都是大气污染物,它们在空气中都能稳定存在 C. 水泥、玻璃、陶瓷是生产生活中用量最大的无机非金属材料 D. 用NH4Cl浓溶液除铁锈,因为NH4Cl水解显酸性
|
|
| 2. | 详细信息 |
|
下列关于有机物的说法正确的是 A. 棉、麻、羊毛完全燃烧都只生成CO2和H2O B. C. 乙醇、乙酸、乙酸乙酯都能发生取代反应 D. 只用水无法鉴别苯、乙酸和四氯化碳
|
|
| 3. | 详细信息 | |||||||||||||||
|
下列实验操作规范且能达到实验目的的是
A. A B. B C. C D. D
|
||||||||||||||||
| 4. | 详细信息 |
|
设NA表示阿伏伽德罗常数,下列叙述中正确的是 A. 32g O2和O3的混合气体含有的分子总数小于NA B. 1mol CH3+(碳正离子)中含有电子数为10NA C. 0.1mol氯化氢气体溶于水所得溶液中含有0.1NA个HCl分子 D. 1L 0.1mol/L 的葡萄糖溶液中,含有的分子数为NA个
|
|
| 5. | 详细信息 |
|
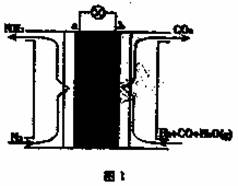
某课外小组运用电化学原理合成氨,其装置结构如图1所示。下列有关说法不正确的是
A. 放电时,b极表面H2和CO均被氧化 B. 该电池工作时,H+由b极区迁移至a极区 C. a极的电极反应为N2+6H++6e-=2NH3 D. b极区发生反应CO+H2O=CO2+H2
|
|
| 6. | 详细信息 |
|
W、X、Y、Z是原子序数依次增大的短周期主族元素。X的单质经常作为保护气,这四种元素可以组成阴阳离子个数比是1:1的离子化合物甲,由Y、Z形成的一种化合物乙和W、Z 形成的化合物丙反应生成淡黄色固体。下列说法中不正确的是 A. 化合物甲一定能与NaOH溶液反应 B. 原子半径大小顺序是Z>X>Y>W C. W、X组成的化合物X2W4是共价化合物 D. W、X、Y组成的化合物水溶液一定呈酸性
|
|
| 7. | 详细信息 |
|
室温下,向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是 A. 溶液中导电粒子的数目减少 B. 溶液中c(CH3COO-)/c(CH3COOH)•c(OH-)不变 C. 醋酸的电离程度增大,c(H+)也增大 D. 再加入10mL pH=11的NaOH溶液,混合液的pH=7
|
|
| 8. | 详细信息 |
|
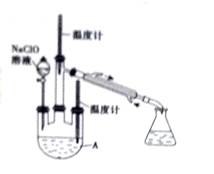
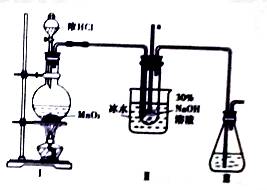
水合肼是一种重要的精细化工原料,纯品为无色透明的油状液体,在高温下分解,水合肼具有还原性,在农药、医药及有机合成中有广泛用途。 用尿素法制备水合肼,反应方程式为:CO(NH2)2+NaClO+2NaOH=N2H4•H2O+NaCl+Na2CO3 实验步骤: 步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液. 步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中(如图),0.5h左右滴完. 步骤3.在三口烧瓶(见图)中加入5g KMnO4作催化剂,急速升温,在108℃回流5min,制取粗产品.
(1)配制30%的NaOH溶液需要的玻璃仪器有___________、__________和烧杯。 (2)用如图装置制取NaClO。
①Ⅱ中的导管a的作用是___________。 ②已知3NaClO ③氯气中含有氯化氢,能降低NaClO产率,除去杂质气体的试剂是__________。 (3)步骤2中若将尿素滴加到NaClO中,降低水合肼的产率,原因是________(用化学方程式表示)。 (4)步骤1中检测NaClO浓度的目的是__________。 (5)N2H4有较强的还原性,在银的提取过程中有重要的应用,N2H4可以直接还原AgCl得到银单质,反应的化学方程式是____________。
|
|
| 9. | 详细信息 | |||||||||||||||||||||||||
|
(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。 已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8KJ/mol C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518KJ/mol 试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________ (2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有: 甲:CO2(g)+3H2(g) 乙:CO2(g)+H2(g) ①CO(g)+2H2(g) ②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。 ③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
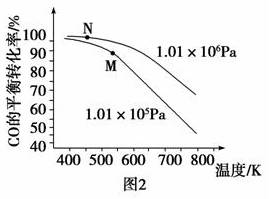
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。 (3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。
①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。 ②三个容器中一定达到平衡状态的是容器________(填写容器代号)。 ③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。
|
||||||||||||||||||||||||||
| 10. | 详细信息 |
|
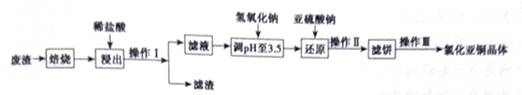
铜及其化合物有广泛的应用。氯化亚铜(CuCl)微溶于水,不溶于酒精,在潮湿空气中易水解氧化。某课外小组以某工业废渣(主要成分为硅、铜、碳等)为原料制备CuCl的流程示意图如图所示。
(1)“滤渣”的主要成分为______(填化学式)。 (2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:_________。 (3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是______(用化学方程式表示)。 (4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是__________。 (5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是__________,操作Ⅲ中包括对滤饼的醇洗,醇洗的目的是_________。 (6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl-
|
|
| 11. | 详细信息 |
|
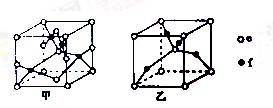
a、b、c、d、e、f是前四周期原子序数依次增大的6种元素,a元素的基态原子核外s能级上的电子数是p能级上电子数的2倍;c元素原子的最外层电子数是次外层电子数的3倍;d是地壳中含量最高的金属元素;e的正三价基态离子的d能级为半充满结构;f的基态原子最外层只有一个电子,且内层电子排布均为全充满结构。 (1)b元素基态原子的价电子排布图为________。 (2)a、b、c三种元素的第一电离能由大到小的顺序为_________。(用元素符号回答) (3)b与c组成的一种分子甲中有16个价电子,甲分子与______(填写一种物质的分子式)是等电子体,甲分子中σ键和π键的数目比是______。 (4)c的氢化物中,电子总数为18的分子是乙,乙中c原子的杂化方式为_______。它是______分子(填“极性”或“非极性”) (5)已知c、f能形成两种化合物,其晶胞如图所示,甲的化学式为_________。高温时,甲易转化为乙的原因为_________。
(6)e元素对应的单质在形成晶体时,采用如图23所示的堆积方式_________。则这种堆积模型的配位数为,如果e的原子半径为 r pm;阿伏伽德罗常数的值为NA,计算此单质的密度表达式为_______g/cm3。
|
|
| 12. | 详细信息 |
|
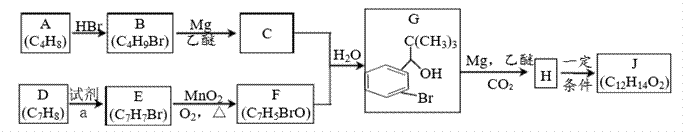
丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图24所示:
已知: (1)A的名称是_______;E到F的反应类型是___________。 (2)试剂a是________,F中官能团名称是_______。 (3)E的含苯环同分异构体共有______种(不含E)。 (4)J是一种酯,分子中除苯环外还含有一个五元环,J的结构简式为__________-。H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为________。 (5)利用题中信息写出以乙醛和苯为原料,合成
|
|