2020湖南高一下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 | |||
|
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫作化学用语。下列有关化学用语的表示方法中错误的是( )
B.S2-的结构示意图: C.O-18的原子符号:
|
||||
| 2. | 详细信息 |
|
下列叙述错误的是( ) A.13C和14C属于同一种元素,它们互为同位素 B.6Li和7Li的电子数相等,中子数也相等 C.14C和14N的质量数相等,中子数不相等 D.1 mol
|
|
| 3. | 详细信息 |
|
设阿伏加德罗常数的值为NA,下列说法正确的是( ) A.1 mol苯乙烯中含有的 B.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA C.0.1 mol CnH2n+2中含有的C—C键数为0.1nNA D.标准状况下,2.24 L CCl4中含有的分子数为0.1NA
|
|
| 4. | 详细信息 |
|
A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍。下列说法正确的是( ) A.原子半径的大小顺序:r(B)>r(C)>r(D) B.C的最高价氧化物对应水化物的碱性在同周期中最强 C.E分别与A、C形成的化合物中化学键类型相同 D.B的简单气态氢化物的热稳定性比D的弱
|
|
| 5. | 详细信息 |
|
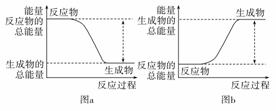
如图所示,有关化学反应和能量变化的说法正确的是( )
A.a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 B.图b中反应物比生成物稳定 C.图a表示的是吸热反应的能量变化图 D.图a不需要加热就一定能发生,图b一定需要加热才能发生
|
|
| 6. | 详细信息 |
|
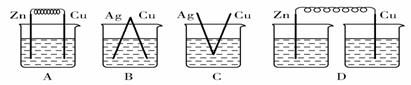
下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )
|
|
| 7. | 详细信息 |
|
下列关于有机物的说法正确的是( ) A.乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同 B.交警用酸性重铬酸钾溶液检查司机是否饮酒时乙醇发生取代反应 C.乙酸的分子式为CH3COOH,属于弱电解质 D.苯分子中没有碳碳双键,因此苯不能发生加成反应
|
|
| 8. | 详细信息 |
|
下列关于有机化合物性质和结构的叙述中正确的是( ) A.甲烷、苯、淀粉、蛋白质完全燃烧的产物都只有二氧化碳和水 B.油脂属于酯,在酸性条件下的水解产物都是醇和有机酸 C.苯与液溴在铁作催化剂的条件下的反应为加成反应 D.葡萄糖、蔗糖、淀粉都可以食用,都能发生水解反应
|
|
| 9. | 详细信息 |
|
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)( ) A.6种 B.7种 C.8种 D.9种
|
|
| 10. | 详细信息 |
|
下列物质的变化过程中,有共价键明显被破坏的是( ) A.I2升华 B.NaCl颗粒被粉碎 C.盐酸和NaOH溶液混合 D.从NH4HCO3中闻到了刺激性气味
|
|
| 11. | 详细信息 |
|
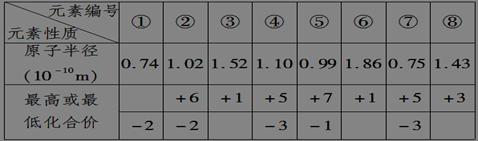
现有下列短周期元素性质的数据,回答下列问题:
(1)元素③在周期表中位置是____________________;元素④与元素⑦相比较,气态氢化物较稳定的是________(填化学式); (2)元素①是________(写元素符号),元素⑥是________(写元素符号),二者按照原子个数比为1∶1形成的化合物与水反应的化学方程式为: 。 (3)元素⑤与元素②的非金属性强弱顺序为________(写元素符号),元素⑤的单质通入到元素②的氢化物的水溶液中,反应的化学方程式为: 。 (4)用电子式表示元素①氢化物的形成过程 。写出元素⑦氢化物的电子式________;写出实验室制元素⑤单质的化学反应方程式__________________________________________________________。
|
|
| 12. | 详细信息 | ||||||||||||
|
化学反应速率和限度与生产、生活密切相关。 (1)某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
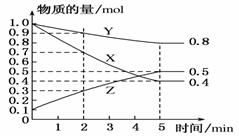
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是 。 ②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率________(设溶液体积不变)。 (2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。 A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液 (3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是_____________________。 ②该反应达到平衡状态的标志是________(填字母)。 A.Y的体积分数在混合气体中保持不变 B.X、Y的反应速率比为3∶1 C.容器内气体压强保持不变 D.容器内气体的总质量保持不变 E.生成1 mol Y的同时消耗2 mol Z ③2 min内Y的转化率为________。
|
|||||||||||||
| 13. | 详细信息 |
|
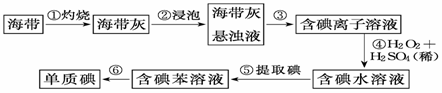
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白: (1)步骤①中灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 ; ; ; 。 (2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 _____________。 (3)步骤④反应的离子方程式是 。 (4)步骤⑤中,某同学选择用苯来提取碘的理由是 。 (5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
|
|
| 14. | 详细信息 |
|
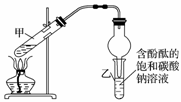
某学习小组在实验室制取乙酸乙酯的主要步骤如下: ①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。 ②按如图连接好装置并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。 ④分离出乙酸乙酯,洗涤、干燥。 回答问题: (1)配制混合液的操作顺序是 。 (2)装置中球形干燥管,除起冷凝作用外,另一重要作用是________________。 (3)步骤②安装好实验装置,加入药品前还应检查________________。 (4)写出实验中加热试管的目的:① ;② 。 (5)反应中浓硫酸的作用是________________;写出能表示18O位置的制取乙酸乙酯的化学方程式: (6)上述实验中饱和碳酸钠溶液的作用是________。(填字母) A.反应掉乙酸和乙醇 B.反应掉乙酸并吸收部分乙醇 C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出 D.加速酯的生成,提高其产率 (7)步骤③所观察到的现象是 从试管乙中分离出乙酸乙酯的实验操作名称是
|
|