2019浙江高一上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列属于盐的是 A. 生石灰 B. 盐酸 C. 纯碱 D. 氢氧化钠
|
|
| 2. | 详细信息 |
|
下列仪器对应的名称正确的是
|
|
| 3. | 详细信息 |
|
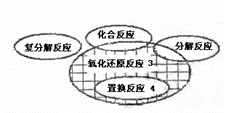
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是 A.Cl2+2KBr = Br2+2KCl B.2NaHCO3 = Na2CO3+H2O+CO2↑ C.4Fe(OH)2+O2+2H2O= 4Fe(OH)3 D.CH4 + 2O2==CO2 + 2H2O
|
|
| 4. | 详细信息 |
|
飘尘是物质燃烧时 A.氧化剂 B.还原剂 C.催化剂 D.载体
|
|
| 5. | 详细信息 |
|
下列说法正确的是 A. 用饱和碳酸钠溶液可以除去 B.海水中氯化钠的含量最高 C.科学研究 D.电解饱和食盐水制取氯气等产品的工业称为“氯碱工业”
|
|
| 6. | 详细信息 |
|
下列物质均有漂白作用,但其中一种的漂白原理与其它三种不同的是 A.HClO B.SO2 C.O3 D.H2O
|
|
| 7. | 详细信息 |
|
下列化合物中,不能通过单质间化合直接制取的是 A.Na2O2 B.CuCl2 C.SO3 D.FeS
|
|
| 8. | 详细信息 |
|
下列关于硫酸性质的描述中,正确的是 A.浓H2SO4有氧化性,稀H2SO4无氧化性 B.由于浓H2SO4具有脱水性,所以可用做干燥剂 C.接触法制硫酸的硫元素主要来源于硫黄或含硫矿石,它们与氧气反应生成二氧化硫的设备是沸腾炉 D.在受热的情况下浓硫酸也不与铁、铝发生反应
|
|
| 9. | 详细信息 |
|
下列说法中,正确的是 A.在多电子的原子里,能量高的电子通常在离核近的区域内运动 B.门捷列夫提出的元素周期律为发现新元素、寻找新材料提供了新思路 C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 D.微粒的最外层只能是8个电子才稳定
|
|
| 10. | 详细信息 |
|
下列关于胶体的叙述不正确的是 A.胶体区别于其他分散系的本质特征是分散质粒子直径在1 nm ~100 nm之间 B C.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 D.分别用一束光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相
|
|
| 11. | 详细信息 |
|
.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断不正确的是 A.最高正化合价:X<Y<Z B.原子半径:X<Y<Z
|
|
| 12. | 详细信息 |
|
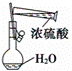
下列图示中正确的实验操作是 A. 除去CO中的CO2 C. 稀释浓硫酸
|
|
| 13. | 详细信息 |
|
下列说法正确的是 A.1 mol H+的质量是1 g B.标准状况下,1 mol水占的体积是22.4 L C.二氧化硫的摩尔质量是64 g D.1 L 1 mol·Lˉ1盐酸溶液中,有1 mol HCl分子
|
|
| 14. | 详细信息 |
|
二氧化氯(ClO2)是一种高效消毒剂,下列反应可制得ClO2: 2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,对于该反应,下列说法正确的是 A. 生成1mol ClO2,转移电子数为NA B. 该反应为复分解反应 C. H2SO4发生氧化反应 D. NaClO3是还原剂
|
|
| 15. | 详细信息 |
|
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是 A. 向氯水中滴加稀盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明氯水中含有Cl- B. 氯水使有色布条褪色,说明氯水中含有HClO C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D. 向氢氧化钠溶液中滴加氯水,溶液黄绿色消失,说明氯水中含有Cl2
|
|
| 16. | 详细信息 |
|
下列说法不正确的是 A.二氧化硅用于制造光导纤维 B. 常用pH试纸测定新制氯水的pH值 C.一定条件下,金属镁可以置换出碳单质 D. 碳酸氢钠是发酵粉的主要成份
|
|
| 17. | 详细信息 | ||||||||||
|
下列装置或操作能达到实验目的是
|
|||||||||||
| 18. | 详细信息 |
|
下列有关Na2CO3和NaHCO3性质的说法中,正确的是 A.Na2CO3俗称纯碱或苏打,是治疗胃酸过多的一种药物。
C.等质量的Na2CO3和NaHCO3分别与等物质的量浓度的过量盐酸反应,完全反应后,在相同条件下NaHCO3 产生的CO2气体的体积大,反应速率也是NaHCO3快。 D.Na2CO3 溶液中混有NaHCO3时可用加热的方法除去
|
|
| 19. | 详细信息 |
|
下列关于物质用途的叙述中,不正确的是 A.钾钠合金呈液态,可做快中子反应堆的导热剂 B.硅酸钠俗称“水玻璃”,是制造水泥的原料 C.硅是太阳能电池的常用材料 D.氧化镁的熔点高达2800℃,是优质的耐高温材料
|
|
| 20. | 详细信息 |
|
下列方程式表达,正确的是 A. 碳酸钡跟醋酸反应:BaCO3+2CH3COOH=Ba2++2CH3COO−+CO2↑+H2O
|
|
| 21. | 详细信息 |
|
能与SO2气体发生反应且有沉淀产生的是 ①NaOH溶液 ②H2O2和BaCl2的混合溶液 ③BaCl2溶液 ④BaCl2和NaOH的混合液 A.①②③ B.②④ C.全部 D.①③④
|
|
| 22. | 详细信息 |
|
下列物质的工业制法正确的是 A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛 B.炼铁:炼铁高炉中碳在高温下还原铁矿石中的铁 C.制钠:用海水作原料制得精盐,再电解熔融的氯化钠得到金属钠 D.炼硅:用焦炭与二氧化硅在高温下反应生成粗硅和二氧化碳
|
|
| 23. | 详细信息 |
|
往FeCl2溶液中滴加溴水,溶液变为黄色,下列说法正确的是 A.由于溶液存在Br2,所以溶液为黄色 B.往所得溶液中加入硫氰化钾溶液,可判断是否生成了Fe3+ C.往所得溶液中加入足量氢氧化钾溶液,不能判断是否生成了Fe3+ D.往所得溶液中加入淀粉碘化钾溶液,可判断是否生成了Fe3+
|
|
| 24. | 详细信息 |
|
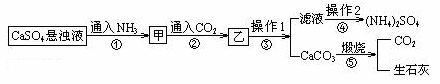
(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4的工艺流程如下:
下列说法正确的是 A.通入NH3和CO2的顺序可以颠倒 B.操作1为过滤,操作2为蒸馏 C.通入的 D.步骤②中反应的离子方程式为CaSO4+2NH3+CO2+H2O=CaCO3↓+2NH4++SO42-
|
|
| 25. | 详细信息 |
|
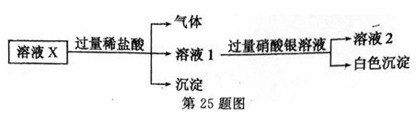
已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl—、Br—、CO32-、SiO32-、SO42-中的几种离子。为了确定其组成,某同学进行了如下实验:
下列说法正确的是 A B.溶液X中一定含有Na+、Cl—和SiO32- C.为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 D.白色沉淀为AgCl和Ag2SO4
|
|
| 26. | 详细信息 |
|
按要求完成下列填空: (1)漂白粉溶液在空气中放置失效,发生反应的离子方程式: 。 (2)次氯酸的电离方程式: 。 (3)氯化铁溶液与单质铜反应的化学方程式: 。
|
|
| 27. | 详细信息 |
|
取44.2g碳酸钠和碳酸氢钠的混合粉 试计算(计算结果用小数形式表示): (1)原样品中碳酸氢钠的物质的量为 mol。 (2)所配溶液中Na+的物质的量浓度为 mol·L-1。
|
|
| 28. | 详细信息 | |||
|
我国有丰富的海水资源,开发和利用 (1)被称作海洋元素的是 (写元素符号)。 (2)工业上常以饱和食盐水为原料制备氯气,请写出反应的化学反应方程式 。 (3)从海水中提取食盐和溴的过程如下:
①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式, ②步骤Ⅱ中通入空气吹出溴,是利用了溴的 性质,步骤Ⅲ得到工业溴的化学方程式为: 。
|
||||
| 29. | 详细信息 |
|
取一定量的CuCl2产品投入Na2CO3溶液中,充分反应生得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:
(1)混合气体的成分是 ;X的化学式为 。 (2)写出CuCl2与Na2CO3反应生成X的离子方程式 。
|
|
| 30. | 详细信息 |
|
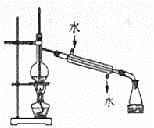
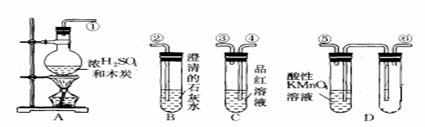
为验证木炭可和浓硫酸反应生成的气体产物,选用下图中的仪器(含所盛物质)组装成套实验装置,回答下列问题。
(1)在实验进行中,按气流方向从左到右的 接 , 接 , 接 。 (2)D中右边试管的作用是 。 (3)试管B、C中各有什么现象,才能表示已检验出二氧化碳? 。 (4)试管D中能否用饱和NaHCO3溶液代替酸性KMnO4溶液?说明理由: 。
|
|
| 31. | 详细信息 |
|
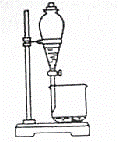
为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。
已知:3Fe(s)+4H2O(g) 请回答: (1)虚线框处宜选择的装置是______(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________________________ _______________________________________________________________________________。 (2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没 _______________________________________________________________________________。
|
|

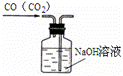 B.
B. 
 D.
D.