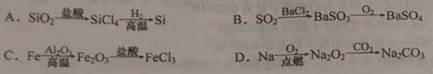2018高一上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
国产自主研发芯片麒麟970是全球首款内置神经网络单元的处理器,该处理器芯片中使用的材料是 A.硅 B.钛合金 C.二氧化硅 D.铅合金
|
|
| 2. | 详细信息 |
|
下列物质属于纯净物的是 A.氨水 B.铝热剂 C.液氯 D.石油
|
|
| 3. | 详细信息 |
|
下列过程只涉及物理变化的是 A.硫酸除锈 B.盐酸挥发 C.铁的钝化 D.氯气消毒
|
|
| 4. | 详细信息 |
|
能使品红溶液褪色的气体是 A.NH3 B.HCl C.CH4 D.Cl2
|
|
| 5. | 详细信息 |
|
下列化学用语表示正确的是 A.NaH中H的化合价:-1 B.小苏打的化学式:NaCO3
|
|
| 6. | 详细信息 |
|
下列有关物质的性质与用途具有对应关系的是 A.氢氟酸显弱酸性,可用于雕刻玻璃 B.钠具有强还原性,可用于制作高压钠灯 C.氢氧化铝受热易分解,可用作胃酸中和剂 D.液氨气化时要洗手大量的热,可用作制冷剂
|
|
| 7. | 详细信息 |
|
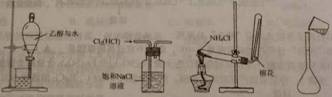
下列实验操作正确的是 A.分离乙醇和水 B.除去氯气中的氯化氢 C.制取氨气 D.转移溶液
|
|
| 8. | 详细信息 |
|
25℃时,下列各组离子在指定溶液中一定能大量共存的是
|
|
| 9. | 详细信息 |
|
下列变化中不涉及氧化还取反应的是
|
|
| 10. | 详细信息 |
|
下列说法正确的是
|
|
| 11. | 详细信息 |
|
下列气体中不能用排空气法收集的是 A.NO B.SO2 C.NH3 D.H2
|
|
| 12. | 详细信息 |
|
.下列各组物质能用括号内的试剂或仪器鉴别的是 A.NaHCO3和Na2CO3两种溶液[Ca(OH)2溶液] B. NaCl和Na2SO4两种溶液(激光笔) C. MgCl2溶液AlCl3两种溶液(NaOH溶液) D. Fe2(SO4)3)和FeCl3两种溶液(KSCN溶液)
|
|
| 13. | 详细信息 |
|
下列有关CO2和SO2的说法中,正确的是 A.大量排放都能形成酸雨 B.都具有刺激性气味 C. 都能使澄清石灰水变浑浊 D.都能使品红溶液褪色
|
|
| 14. | 详细信息 |
|
下列关于浓硫酸的说法中,正确的是 A.浓硫酸可用于肝燥氨气 B. 浓硫酸可使纸张脱水炭化 C.浓硫酸必须保存在棕色瓶中 D.可用锌和浓硫酸反应制取氢气
|
|
| 15. | 详细信息 |
|
酸性条件下, NaCl05和Na2S03反应可生成Cl02和Na2S04。向10.00 mL 0.2 mol•L-1酸性NaClO3溶液中滴加Na2S03,欲使NaC103恰好完全反应,则所需0.1 mol•L-1的Na2S03 溶液的体积为 A. 5.00 mL B.10.00mL C.15.00mL D.20.00 mL
|
|
| 16. | 详细信息 |
|
A. NO2被氧化 B. CO是氧化剂 C.每生成28gN2,转移8mole- D.该条件下,还原性CO<N2
|
|
| 17. | 详细信息 |
|
在给定的条件下,下列选项所示的物质间转化均能实现的是
|
|
| 18. | 详细信息 |
|
下列物质分离的方法中,正确的是 用加热法除去氯化钠固体中的氯化铵 用NaOH溶液除去Fe203中的Al203 用铜粉除去Fe2C12溶液中的FeC13 用饱和Na2C05溶液除去C02中的HC1
|
|
| 19. | 详细信息 |
|
下列离子方程式正确的是 A.用盐酸溶解石灰石:C032-+2H+ = C02↑+H20 B.CuS04溶液与 Ba(OH)2: Ba2+ + SO42- = BaS04↓ C.将S02气体通入足量NaOH溶液中:S02 + 20H-= S032-+H20 D.溴化钠溶液与氯气反应:2Br-+Cl2=Br2+2Cl-
|
|
| 20. | 详细信息 |
|
下列对有关实验寧实的说明或解释正确的是 A.用坩埚钳夹住一小块用砂纸打磨过的铝箔在洒精灯上加热,铝熔化但不滴落,说明Al203的熔点高于Al B.向某溶液中先淌加Ba(N03)2溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解,说明原溶液中一定含有SO42- C.向新制氯水中加入少量NaHCO3固体,出现较多气体,说明HClO的酸性强于H2CO3 D.向某溶液中先滴加KSCN溶液,溶液不变红,再滴加双氧水,溶液变红,说明原溶液中一定含有Fe2+
|
|
| 21. | 详细信息 |
|
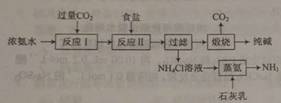
某种制取纯碱的方法如下:
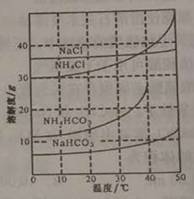
(1)写出“反应I ”的化学方程式:_▲_。 (2) “反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:_▲_。 ⑶写出“煅烧”反应的化学方程式:_▲_。 (4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式: _▲_。 (5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: _▲_。
|
|
| 22. | 详细信息 |
|
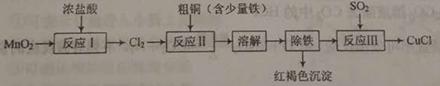
实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:
(1) “反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 _▲_。 (2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为_▲_。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为_▲_。 (4) “反应Ⅲ”的离子方程式为__▲_。 (5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为__▲_。
|
|
| 23. | 详细信息 |
|
有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,B为黑色雌性氧化物, E为常见的强碱。
(1)D的化学式为_▲_。 (2)写出反应①的离子方程式:_▲_。 (3)写出反应②的离子方程式:_▲_。 (4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:_▲_。
|
|
| 24. | 详细信息 |
|
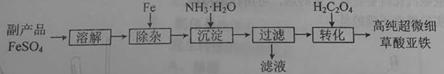
利用钛白工业的副产品FeS04[杂质仅为少量Fe2(S04)3]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
(1)用离子方程式表示“除杂”的原理:_▲_。 (2) “沉淀”过程控制反应温度为40℃,温度不宜过高的原因是_▲_。(3)实验室测定副产品FeSO4杂质仅为少量Fe2(S04)3]+ Fe2(SO4)3含量的步骤如下: 步骤1:将适量副产品配成水溶液,向其中加入2mol•L-1BaCl2溶液使S042-沉淀完全,过滤。 步骤2:将步骤1所得沉淀洗涤,烘干至恒重,称得其质量为11.65 g。 步骤3:用0.2000mol•L-1KMnO4溶液与步骤1所得滤液作用,恰好完全反应时消耗其体积为20.00 mL。 (该步骤中反应的方程式为:5Fe2+ + Mn04- + 8H+ = 5Fe3++Mn2++4H20) ①步骤1中证明SO42-沉淀完全的操作为_▲_。 ②欲配制0.2000 mol•L-1 KMn04 50 mL,若定容时俯视,则所配KMnO4溶液浓度会 ▲ 。(填“偏大”、“偏小”、“不变”) ③该副产品中所含杂质Fe2(S04)3的物质的量为_▲_。
|
|
| 25. | 详细信息 |
|
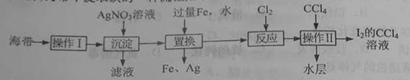
海带中提取碘的一种流程如下:
(2) “置换”所得滤渣中含有Fe和Ag。 ①使用化学方法分离出Ag操作是_▲_。 ②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为_▲_。 (3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡 静置,_▲_。 (4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是_▲_。
|
|