2019зҰҸе»әй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺзӨҫдјҡгҖҒз”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) В В AпјҺдәҢж°§еҢ–зЎ«еҸҜе№ҝжіӣз”ЁдәҺеҗ„зұ»йЈҹе“Ғзҡ„жјӮзҷҪ В В BпјҺд»Һжө·ж°ҙжҸҗеҸ–д»»дҪ•зү©иҙЁйғҪеҝ…йЎ»йҖҡиҝҮеҢ–еӯҰеҸҚеә”жүҚиғҪе®һзҺ° В В CпјҺз”Ёзғӯзҡ„зәҜзўұжә¶ж¶Іжё…йҷӨжІ№ең¬ В В DпјҺвҖңең°жІҹжІ№вҖқзҰҒжӯўйЈҹз”ЁпјҢд№ҹдёҚиғҪз”ЁжқҘеҲ¶иӮҘзҡӮ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺеҗ„дёә0.1 molзҡ„зҫҹеҹәпјҲвҖ”OHпјүе’ҢOH-дёӯеҗ«жңүзҡ„з”өеӯҗж•°зӣ®еқҮдёә0.9NA BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 L O2дёҺ44.8 L SO2е……еҲҶеҸҚеә”еҗҺиҪ¬з§»з”өеӯҗзҡ„ж•°зӣ®дёә4NA CпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2 LиӢҜдёӯжүҖеҗ«зҡ„еҲҶеӯҗж•°дёә0.5NA DпјҺ1L 0.1 mol/Lзҡ„NaClOжә¶ж¶Ідёӯеҗ«жңүзҡ„ClO-зҰ»еӯҗж•°зӣ®е°ҸдәҺ0.1NA
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺе®һйӘҢе®Өз”Ёзӣҗй…ёй…ёеҢ–й«ҳй”°й…ёй’ҫжә¶ж¶ІВ В В В В BпјҺй“ҒеҲ¶жҲ–й“қеҲ¶е®№еҷЁеҸҜд»ҘзӣӣиЈ…зғӯзҡ„жө“зЎ«й…ё CпјҺеёёжё©дёӢпјҢжүҖжңүеҗёзғӯеҸҚеә”йғҪдёҚиғҪиҮӘеҸ‘иҝӣиЎҢ DпјҺйҷӨеҺ»MgCl2жә¶ж¶Ідёӯе°‘йҮҸFeCl3жқӮиҙЁпјҢеҸҜеҠ е…Ҙи¶ійҮҸзҡ„MgOзІүжң«жҗ…жӢҢеҗҺиҝҮж»Ө
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй“ңз”өжһҒзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺй“ңй”ҢеҺҹз”өжұ дёӯй“ңжҳҜиҙҹжһҒВ В В В В В В В В В В В BпјҺз”Ёз”өи§Јжі•зІҫзӮјзІ—й“ңж—¶пјҢзІ—й“ңдҪңйҳҙжһҒ CпјҺеңЁй•Җ件дёҠй•Җй“ңж—¶еҸҜз”ЁйҮ‘еұһй“ңеҒҡйҳіжһҒВ В DпјҺз”өи§ЈзЁҖзЎ«й…ёеҲ¶H2е’ҢO2ж—¶й“ңеҒҡйҳіжһҒ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еҮҶ确移еҸ–20.00mLжҹҗеҫ…жөӢHClжә¶ж¶ІдәҺй”ҘеҪўз“¶дёӯпјҢз”Ё0.1000 molВ·L-1NaOHжә¶ж¶Іж»ҙе®ҡпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖВ гҖҖ) AпјҺж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—ж¶ӨеҗҺпјҢиЈ…е…ҘNaOHжә¶ж¶ІиҝӣиЎҢж»ҙе®ҡ BпјҺйҡҸзқҖNaOHжә¶ж¶Іж»ҙе…ҘпјҢй”ҘеҪўз“¶дёӯжә¶ж¶Ізҡ„pHз”ұе°ҸеҸҳеӨ§ CпјҺз”Ёй…ҡй…һдҪңжҢҮзӨәеүӮпјҢеҪ“й”ҘеҪўз“¶дёӯжә¶ж¶Із”ұзәўиүІеҸҳж— иүІж—¶еҒңжӯўж»ҙе®ҡ DпјҺж»ҙе®ҡиҫҫз»ҲзӮ№ж—¶пјҢеҸ‘зҺ°ж»ҙе®ҡз®Ўе°–еҳҙйғЁеҲҶжңүжӮ¬зқҖж¶Іж»ҙпјҢеҲҷжөӢе®ҡз»“жһңеҒҸе°Ҹ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжё©еәҰдёӢпјҢеңЁжҒ’е®№зҡ„еҜҶй—ӯе®№еҷЁдёӯе»әз«ӢдёӢеҲ—е№іиЎЎпјҡC(s) + H2O(g) вҮҢ CO(g) + H2(g)пјҢдёҚиғҪзЎ®е®ҡдёҠиҝ°еҸҜйҖҶеҸҚеә”еңЁдёҖе®ҡжқЎд»¶дёӢе·ІиҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„жҳҜ(гҖҖгҖҖ) AпјҺж··еҗҲж°”дҪ“зҡ„е№іеқҮеҜҶеәҰдёҚеҶҚеҸ‘з”ҹеҸҳеҢ– BпјҺvжӯЈ(CO) = vйҖҶ(H2O) CпјҺз”ҹжҲҗn mol COзҡ„еҗҢж—¶з”ҹжҲҗn mol H2 DпјҺ1 mol HвҖ”Hй”®ж–ӯиЈӮзҡ„еҗҢж—¶ж–ӯиЈӮ2 mol HвҖ”Oй”®
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮXгҖҒYгҖҒZгҖҒWеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’Ңдёә16пјҢXеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶еҶ…еұӮз”өеӯҗж•°зҡ„2еҖҚпјҢYжҳҜең°еЈідёӯеҗ«йҮҸжңҖй«ҳзҡ„е…ғзҙ пјҢZ2+дёҺY2вҖ”е…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺеҚ•иҙЁзҡ„жІёзӮ№пјҡY>Z BпјҺXгҖҒYгҖҒZдёүз§Қе…ғзҙ дёҚеҸҜиғҪеҪўжҲҗзҰ»еӯҗеҢ–еҗҲзү© CпјҺXзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„й…ёжҖ§жҜ”Wзҡ„ејә DпјҺYеҲҶеҲ«дёҺZгҖҒWеҪўжҲҗзҡ„еҢ–еҗҲзү©дёӯеҢ–еӯҰй”®зұ»еһӢзӣёеҗҢ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжё©еәҰж—¶пјҢе°Ҷ1 mol Aе’Ң2 mol Bж”ҫе…Ҙе®№з§Ҝдёә5 L зҡ„жҹҗеҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡA(s) + 2B(g) вҮҢ C(g) + 2D(g)пјҢз»Ҹ5 minеҗҺпјҢжөӢеҫ—е®№еҷЁеҶ…Bзҡ„жө“еәҰеҮҸе°‘дәҶ0.2 molВ·L-1гҖӮдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺ5 minж—¶е®№еҷЁеҶ…ж°”дҪ“жҖ»зҡ„зү©иҙЁзҡ„йҮҸдёә3 mol BпјҺ5 minж—¶,е®№еҷЁеҶ…Dзҡ„жө“еәҰдёә0.2 molВ·L-1 CпјҺиҜҘеҸҜйҖҶеҸҚеә”йҡҸеҸҚеә”зҡ„иҝӣиЎҢ,е®№еҷЁеҶ…еҺӢејәйҖҗжёҗеўһеӨ§ DпјҺеңЁ5 minеҶ…иҜҘеҸҚеә”з”ЁCзҡ„жө“еәҰеҸҳеҢ–иЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮдёә0.02 molВ·L-1В·min-1
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҲ©з”Ёзӣёе…іж•°жҚ®дҪңеҮәзҡ„жҺЁзҗҶжҲ–еҲӨж–ӯдёҚжӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺеҲ©з”Ёй”®иғҪеӨ§е°Ҹзҡ„ж•°жҚ®пјҢеҸҜд»Ҙдј°з®—еҢ–еӯҰеҸҚеә”зҡ„з„“еҸҳ BпјҺеҲ©з”ЁеҺҹеӯҗеҚҠеҫ„зҡ„ж•°жҚ®пјҢеҸҜжҺЁж–ӯе…ғзҙ зҡ„дё»иҰҒеҢ–еҗҲд»· CпјҺеҲ©з”Ё0.1mol/Lзҡ„йҶӢй…ёжә¶ж¶ІpHж•°жҚ®пјҢеҸҜжҺЁжөӢйҶӢй…ёжҳҜеҗҰдёәејәй…ё DпјҺеҲ©з”ЁдёҚеҗҢжё©еәҰж—¶зҡ„е№іиЎЎеёёж•°зҡ„ж•°жҚ®пјҢеҸҜжҺЁжөӢжҹҗеҸҜйҖҶеҸҚеә”жҳҜеҗҰдёәж”ҫзғӯеҸҚеә”
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
В дёӢеҲ—жңүе…іе®һйӘҢзҡ„йҖүйЎ№жӯЈзЎ®зҡ„жҳҜ(В В В )
|
|||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жҒ’жё©жқЎд»¶дёӢпјҢе°ҶNO2иЈ…е…ҘеёҰжҙ»еЎһзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢеҪ“еҸҚеә”2NO2(g) вҮҢ N2O4(g)пјҢиҫҫеҲ°е№іиЎЎеҗҺпјҢж…ўж…ўеҺӢзј©е®№еҷЁзҡ„дҪ“з§ҜпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺиӢҘдҪ“з§ҜеҮҸе°ҸдёҖеҚҠпјҢеҲҷеҺӢејәдёәеҺҹжқҘзҡ„дёӨеҖҚ BпјҺе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁпјҢж··еҗҲж°”дҪ“йўңиүІдёҖе®ҡдјҡеҸҳжө… CпјҺиӢҘдҪ“з§ҜеҮҸе°ҸдёҖеҚҠпјҢеҲҷеҺӢејәеўһеӨ§пјҢдҪҶе°ҸдәҺеҺҹжқҘзҡ„дёӨеҖҚВ DпјҺе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁпјҢж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗйҮҸеҮҸе°Ҹ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжё©еәҰдёӢпјҢ0.1 molВ·L-1 NaHAзҡ„ејәз”өи§ЈиҙЁжә¶ж¶ІдёӯпјҢе·ІзҹҘиҜҘжә¶ж¶Ідёӯc(H+) < c(OH-)пјҢеҲҷдёӢеҲ—е…ізі»дёҖе®ҡдёҚжӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺc(Na+) = c(HA-) + 2c(A2-) + c(OH-) BпјҺc(H2A) + c(HA-) + c(A2-) = 0.1 molВ·L-1 CпјҺе°ҶдёҠиҝ°жә¶ж¶ІзЁҖйҮҠиҮі0.01 molВ·L-1пјҢc(H+)В·c(OH-)дёҚеҸҳ DпјҺжә¶ж¶ІдёӯеӯҳеңЁпјҡc(Na+) > c(HA-) > c(OH-) > c(H2A) > c(H+) > c(A2-)
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іжІүж·Җжә¶и§Је№іиЎЎзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В ) AпјҺKsp(AB2) < Ksp(CD)пјҢеҲҷзү©иҙЁAB2зҡ„жә¶и§ЈеәҰдёҖе®ҡе°ҸдәҺзү©иҙЁCDзҡ„жә¶и§ЈеәҰ BпјҺеңЁж°ҜеҢ–银зҡ„жІүж·Җжә¶и§Је№іиЎЎдҪ“зі»дёӯпјҢеҠ е…Ҙи’ёйҰҸж°ҙпјҢж°ҜеҢ–银зҡ„KspеўһеӨ§ CпјҺеңЁзЎ«й…ёй’Ўзҡ„жІүж·Җжә¶и§Је№іиЎЎдҪ“зі»дёӯпјҢеҠ е…ҘйҘұе’Ңзўій…ёй’ жә¶ж¶ІпјҢе№іиЎЎдёҚ移еҠЁ DпјҺеңЁж°ҜеҢ–银зҡ„жІүж·Җжә¶и§Је№іиЎЎдҪ“зі»дёӯпјҢеҠ е…ҘзўҳеҢ–й’ҫеӣәдҪ“пјҢж°ҜеҢ–银жІүж·ҖеҸҜиҪ¬еҢ–дёәзўҳеҢ–银жІүж·Җ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
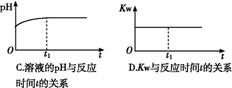
еёёжё©дёӢпјҢзӣҗй…ёдёҺж°ўж°§еҢ–й’ жә¶ж¶Ізӣёдә’ж»ҙе®ҡзҡ„ж»ҙе®ҡжӣІ
AпјҺж»ҙе®ҡиҝҮзЁӢзҡ„д»»дҪ•ж—¶еҲ»йғҪеӯҳеңЁпјҡ c(H+) + c(Na+) пјқ c(OHпјҚ) пјӢ c(ClпјҚ) В В BпјҺжӣІзәҝbжҳҜз”Ёж°ўж°§еҢ–й’ жә¶ж¶Іж»ҙе®ҡзӣҗй…ёжә¶ж¶Ізҡ„ж»ҙе®ҡжӣІзәҝ В В CпјҺж°ўж°§еҢ–й’ жә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә0.1molгғ»LпјҚ1 DпјҺPзӮ№ж—¶жҒ°еҘҪе®Ңе…Ёдёӯе’ҢпјҢжә¶ж¶Іе‘ҲдёӯжҖ§
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
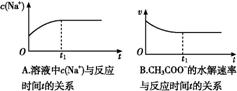
дёӢйқўжҳҜжҹҗеҢ–еӯҰз ”з©¶е°Ҹз»„жҺўз©¶еӨ–з•ҢжқЎд»¶еҜ№еҢ–еӯҰеҸҚеә”йҖҹзҺҮе’ҢеҢ–еӯҰе№іиЎЎеҪұе“Қзҡ„еӣҫиұЎпјҢе…¶дёӯеӣҫиұЎе’Ңе®һйӘҢз»“и®әиЎЁиҫҫеқҮжӯЈзЎ®зҡ„жҳҜ(В В В )
AпјҺв‘ жҳҜе…¶д»–жқЎд»¶дёҖе®ҡж—¶пјҢеҸҚеә”йҖҹзҺҮйҡҸжё©еәҰеҸҳеҢ–зҡ„еӣҫиұЎпјҢжӯЈеҸҚеә”О”H<0 BпјҺв‘ЎжҳҜеңЁе№іиЎЎдҪ“зі»зҡ„жә¶ж¶Ідёӯжә¶е…Ҙе°‘йҮҸKClжҷ¶дҪ“еҗҺеҢ–еӯҰеҸҚеә”йҖҹзҺҮйҡҸж—¶й—ҙеҸҳеҢ–зҡ„еӣҫиұЎ CпјҺв‘ўжҳҜеңЁжңүж— еӮ¬еҢ–еүӮеӯҳеңЁдёӢе»әз«Ӣе№іиЎЎзҡ„еӣҫиұЎпјҢaжҳҜдҪҝз”ЁеӮ¬еҢ–еүӮж—¶зҡ„жӣІзәҝ DпјҺв‘ЈжҳҜдёҖе®ҡжқЎд»¶дёӢпјҢеҗ‘еҗ«жңүдёҖе®ҡйҮҸAзҡ„е®№еҷЁдёӯйҖҗжёҗеҠ е…ҘBж—¶зҡ„еӣҫиұЎеҺӢејәp1>p2
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
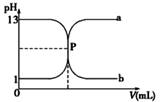
еңЁдёҖе®ҡжё©еәҰдёӢпјҢеҸҚеә” AпјҺ5%В В В В В В В В BпјҺ17%В В В В В В В В В В В В CпјҺ25%В В В В В В В В В В В В В DпјҺ33%
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹе…ғзҙ XгҖҒYгҖҒZгҖҒWзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢдё”еӣӣз§Қе…ғзҙ еҲҶеҲ«дҪҚдәҺдёҚеҗҢзҡ„дё»ж—ҸпјҢе®ғ们зҡ„еҚ•иҙЁеёёжё©дёӢеқҮе‘Ҳж°”жҖҒгҖӮXгҖҒYгҖҒWеӨ„дәҺдёҚеҗҢе‘ЁжңҹпјҢдё”еңЁдёҖе®ҡжқЎд»¶дёӢе…¶еҚ•иҙЁиғҪеҸ‘з”ҹеҸҚеә”пјҡX2+Y2вҶ’з”ІпјҢX2+W2вҶ’д№ҷпјҢе·ІзҹҘпјҢз”ІгҖҒд№ҷеёёжё©дёӢеқҮдёәж°”жҖҒпјҢдё”дёӨиҖ…еңЁз©әж°”дёӯзӣёйҒҮж—¶еҸҜеҢ–еҗҲжҲҗдёҷгҖӮиҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ҙ Yе’ҢZеҜ№еә”зҡ„ж°ўеҢ–зү©жҜ”иҫғзЁіе®ҡзҡ„жҳҜпјҡВ В В В В В В В В В В В В В гҖӮ(еЎ«еҢ–еӯҰејҸ) в‘ө еҢ–еҗҲзү©дёҷеұһдәҺВ В В В В В В В В В В В жҷ¶дҪ“(еЎ«жҷ¶дҪ“зұ»еһӢ)пјҢе…¶ж°ҙжә¶ж¶Іжҳҫй…ёжҖ§пјҢ з”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәе…¶еҺҹеӣ пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ ⑶ XгҖҒZеҸҜз»„жҲҗеӣӣеҺҹеӯҗеҢ–еҗҲзү©дёҒпјҢдёҒдёӯжүҖеҗ«зҡ„еҢ–еӯҰй”®зұ»еһӢдёәпјҡВ В В В В В В В В В В й”®пјҢ иҜ·иҜҙеҮәеҢ–еҗҲзү©дёҒзҡ„дёҖз§Қеёёи§Ғз”ЁйҖ”пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘· XгҖҒYз»„жҲҗзҡ„ж¶ІжҖҒеҢ–еҗҲзү©Y2X4 16 gдёҺи¶ійҮҸдёҒеҸҚеә”з”ҹжҲҗY2е’Ңж¶ІжҖҒж°ҙпјҢж”ҫеҮәQ kJзҡ„зғӯйҮҸпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ Y2X4иҝҳеҸҜд»Ҙе’ҢZ2жһ„жҲҗжё…жҙҒй«ҳж•Ҳзҡ„зҮғж–ҷз”өжұ пјҢиӢҘз”өи§ЈиҙЁжә¶ж¶ІдёәNaOHжә¶ж¶ІпјҢ еҲҷиҙҹжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ё дёҖе®ҡжқЎд»¶дёӢпјҢеҸ– 3.4 gз”Іж°”дҪ“зҪ®дәҺ1 LжҒ’е®№зҡ„е®№еҷЁдёӯпјҢ4еҲҶй’ҹеҗҺпјҢе®№еҷЁеҶ…зҡ„еҺӢејәеҸҳдёәеҺҹжқҘзҡ„1.2еҖҚпјҢдё”дёҚеҶҚеҸҳеҢ–пјҢиҜҘеҸҚеә”дёӯз”Іж°”дҪ“зҡ„иҪ¬еҢ–зҺҮдёәпјҡВ В В В В В В В В гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңү 0.175 molВ·L-1йҶӢй…ёй’ жә¶ж¶І500 mLпјҢ(е·ІзҹҘе®Өжё©дёӢпјҢйҶӢй…ёзҡ„з”өзҰ»е№іиЎЎеёёж•°Ka=1.75Г—10-5)гҖӮ в‘ҙ еҶҷеҮәйҶӢй…ёй’ ж°ҙи§ЈеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣВ в‘ө (еҸҢйҖү)В дёӢеҲ—еӣҫиұЎиғҪиҜҙжҳҺйҶӢй…ёй’ зҡ„ж°ҙи§ЈеҸҚеә”иҫҫеҲ°е№іиЎЎзҡ„жҳҜВ В В В В В В В В В В пјӣ
⑶ (еҸҢйҖү)В еҗ‘йҶӢй…ёй’ жә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸдёӢеҲ—зү©иҙЁпјҢж°ҙи§Је№іиЎЎеҗ‘жӯЈеҗ‘移еҠЁзҡ„жңүВ В В В В пјӣ AпјҺеҶ°йҶӢй…ёВ В В В В BпјҺзәҜзўұеӣәдҪ“В В В В CпјҺйҶӢй…ёй’ еӣәдҪ“В В В В В В DпјҺж°ҜеҢ–й“өеӣәдҪ“ в‘· (еҸҢйҖү)В еңЁйҶӢй…ёй’ жә¶ж¶ІдёӯеҠ е…ҘеҶ°йҶӢй…ёпјҢжә¶ж¶Ідёӯеҫ®зІ’жө“еәҰзҡ„е…ізі»ејҸиғҪжҲҗз«Ӣзҡ„жңүВ В В В В В В В В пјӣ AпјҺc(CH3COO-) + c(CH3COOH) > c(Na+) BпјҺc(Na+) > c(CH3COO-) > c(H+) > c(OH-) CпјҺc(CH3COO-) > c(Na+) > c(H+) > c(OH-) DпјҺc(CH3COO-) > c(H+) > c(OH-) > c(Na+) в‘ё ж¬Ій…ҚеҲ¶0.175 molВ·L-1йҶӢй…ёй’ жә¶ж¶І500 mLпјҢеҸҜйҮҮз”Ёд»ҘдёӢдёӨз§Қж–№жЎҲ: ж–№жЎҲдёҖпјҡз”ЁжүҳзӣҳеӨ©е№із§°еҸ–В В В В В В В В В В gж— ж°ҙйҶӢй…ёй’ пјҢжә¶дәҺйҖӮйҮҸж°ҙдёӯпјҢй…ҚжҲҗ500 mLжә¶ж¶ІгҖӮ[е·ІзҹҘпјҡM(CH3COONa) = 82g/mol ]В ж–№жЎҲдәҢпјҡз”ЁдҪ“з§ҜеқҮдёә250 mLдё”жө“еәҰеқҮдёәВ В В В В В В В В В molВ·L-1зҡ„йҶӢй…ёдёҺж°ўж°§еҢ–й’ дёӨжә¶ж¶Іж··еҗҲиҖҢжҲҗ(и®ҫж··еҗҲеҗҺзҡ„дҪ“з§ҜзӯүдәҺж··еҗҲеүҚдёӨиҖ…дҪ“з§Ҝд№Ӣе’Ң)гҖӮВ в‘№ еңЁе®Өжё©дёӢпјҢ0.175 molВ·L-1йҶӢй…ёй’ (CH3COONa)жә¶ж¶Ізҡ„pHзәҰдёәВ В В В В В В В В гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
|
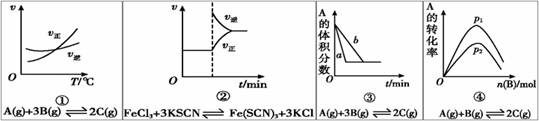
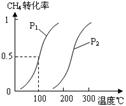
в‘ҙ е°Ҷ1.0 mol CH4е’Ң2.0 mol H2O(g)йҖҡе…Ҙе®№з§Ҝ100Lзҡ„еҸҚеә”е®ӨпјҢдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҡCH4(g) + H2O(g) вҮҢ CO(g) + 3H2(g)вҖҰвҖҰв… пјҢCH4зҡ„иҪ¬еҢ–зҺҮдёҺжё©еәҰгҖҒеҺӢејәзҡ„е…ізі»еҰӮеҸіеӣҫгҖӮ в‘ В В В В е·ІзҹҘ100в„ғж—¶иҫҫеҲ°е№іиЎЎжүҖйңҖзҡ„ж—¶й—ҙдёә5minпјҢеҲҷз”ЁH2иЎЁзӨәзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮ дёәпјҡВ В В В В В В В В В В В В В В В В В В В В В пјӣ в‘Ў еӣҫдёӯзҡ„еҺӢејәP1_В В В В В В _P2пјҲеЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүпјҢ100в„ғж—¶зҡ„ е№іиЎЎеёёж•°дёәпјҡ_В _В В В В В В В В В В В В В В В В В В В В пјӣ в‘ў еңЁе…¶е®ғжқЎд»¶дёҚеҸҳзҡ„жғ…еҶөдёӢйҷҚдҪҺжё©еәҰпјҢйҖҶеҸҚеә”йҖҹзҺҮе°Ҷ_В В В В В В В _(еЎ«вҖңеўһеӨ§вҖқгҖҒвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ в‘ө еңЁеҺӢејәдёә0.1 MPaжқЎд»¶дёӢ, е°Ҷa mol COдёҺ 3aВ mol H2зҡ„ж··еҗҲж°”дҪ“еңЁеӮ¬еҢ–еүӮдҪңз”ЁдёӢиғҪиҮӘеҸ‘еҸҚеә”з”ҹжҲҗз”ІйҶҮпјҡCO(g) + 2H2(g) вҮҢ CH3OH(g) вҖҰвҖҰв…ЎгҖӮ в‘ иӢҘе®№еҷЁе®№з§ҜдёҚеҸҳпјҢдёӢеҲ—жҺӘж–ҪеҸҜжҸҗй«ҳз”ІйҶҮдә§зҺҮзҡ„жҳҜпјҡВ В В В В В В В В В В В В В _пјӣ AпјҺеҚҮй«ҳжё©еәҰВ В В В В В В В В В В В В В В В В В В В В В В В BпјҺе°ҶCH3OH(g)д»ҺдҪ“зі»дёӯеҲҶзҰ» CпјҺе……е…ҘHeпјҢдҪҝдҪ“зі»жҖ»еҺӢејәеўһеӨ§В В В В В В В DпјҺеҠ е…Ҙжӣҙй«ҳж•Ҳзҡ„еӮ¬еҢ–еүӮ в‘Ў дёәдәҶеҜ»жүҫеҗҲжҲҗз”ІйҶҮзҡ„йҖӮе®ңжё©еәҰе’ҢеҺӢејәпјҢжҹҗеҗҢеӯҰи®ҫи®ЎдәҶдёүз»„е®һйӘҢпјҢйғЁеҲҶе®һйӘҢжқЎд»¶е·Із»ҸеЎ«еңЁдёӢйқўе®һйӘҢи®ҫи®Ўзҡ„иЎЁдёӯпјҢиҜ·её®д»–е®ҢжҲҗиҜҘиЎЁгҖӮ
иЎЁдёӯв… гҖҒв…ЎгҖҒв…ўеҲҶеҲ«дёәпјҡВ В В В В В В В В гҖҒВ В В В В В В В В В В гҖҒВ В В В В В В В В В В гҖӮ
|
|||||||||||||||||
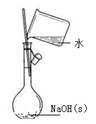
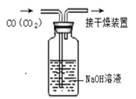
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
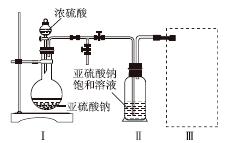
е®һйӘҢдёҖгҖҖз„ҰдәҡзЎ«й…ёй’ зҡ„еҲ¶еҸ– йҮҮз”ЁеҰӮеӣҫиЈ…зҪ®(е®һйӘҢеүҚйҷӨе°ҪиЈ…зҪ®еҶ…зҡ„з©әж°”)еҲ¶еҸ–Na2S2O5гҖӮиЈ…зҪ®в…ЎдёӯжңүNa2S2O5жҷ¶дҪ“жһҗеҮәпјҢеҸ‘з”ҹзҡ„еҸҚеә”дёәNa2SO3 пјӢ SO2 = Na2S2O5гҖӮ в‘ҙ иЈ…зҪ®в… дёӯдә§з”ҹж°”дҪ“зҡ„еҢ–еӯҰж–№зЁӢејҸдёә________________________________пјӣ в‘ө дёҠеӣҫдёӯзӣӣиЈ…жө“зЎ«й…ёзҡ„зҺ»з’ғд»ӘеҷЁзҡ„еҗҚз§°жҳҜ:__________________________;
е®һйӘҢдәҢгҖҖз„ҰдәҡзЎ«й…ёй’ зҡ„жҖ§иҙЁпјҲNa2S2O5жә¶дәҺж°ҙеҚіз”ҹжҲҗNaHSO3пјү в‘· иҜҒжҳҺNaHSO3жә¶ж¶ІдёӯHSO aпјҺжөӢе®ҡжә¶ж¶Ізҡ„pHВ В В В В bпјҺеҠ е…ҘBa(OH)2жә¶ж¶ІВ В В В В В cпјҺеҠ е…Ҙзӣҗй…ё dпјҺеҠ е…Ҙе“Ғзәўжә¶ж¶ІВ В В В В В eпјҺз”Ёи“қиүІзҹіи•ҠиҜ•зәёжЈҖжөӢ е®һйӘҢдёүгҖҖи‘Ўиҗ„й…’дёӯжҠ—ж°§еҢ–еүӮж®Ӣз•ҷйҮҸзҡ„жөӢе®ҡ в‘ё и‘Ўиҗ„й…’еёёз”ЁNa2S2O5дҪңжҠ—ж°§еҢ–еүӮгҖӮжөӢе®ҡи‘Ўиҗ„й…’дёӯжҠ—ж°§еҢ–еүӮзҡ„ж®Ӣз•ҷйҮҸ(д»ҘжёёзҰ»SO2и®Ўз®—)зҡ„ж–№жЎҲеҰӮдёӢпјҡ(ж»ҙе®ҡж—¶еҸҚеә”дёәSO2 пјӢ I2 пјӢ 2H2O = H2SO4 пјӢ 2HI)
в‘ дёҠиҝ°ж»ҙе®ҡиҝҮзЁӢдёӯзҡ„з»ҲзӮ№зҺ°иұЎдёә______________________________________пјӣ в‘ЎжҢүдёҠиҝ°ж–№жЎҲе®һйӘҢпјҢж¶ҲиҖ—ж ҮеҮҶI2жә¶ж¶І25.00 mLпјҢиҜҘж¬Ўе®һйӘҢжөӢеҫ—ж ·е“ҒдёӯжҠ—ж°§еҢ–еүӮзҡ„ж®Ӣз•ҷйҮҸ(д»ҘжёёзҰ»SO2и®Ўз®—)дёә____________gВ·LпјҚ1гҖӮ
|
|
- й«ҳдёҖдёҠжңҹ第дәҢж¬Ўж®өиҖғеҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙе№ҝдёңзңҒдёӯеұұзәӘеҝөдёӯеӯҰпјү
- й«ҳдёүеҢ–еӯҰдё“йўҳз»ғд№ пјҲ2020е№ҙдёҠеӯҰжңҹпјүиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- дёүиҪ®еҶІеҲәй«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- еӨ©ж°ҙеёӮй«ҳдёүеҢ–еӯҰ2019е№ҙдёӢеҚҠе№ҙй«ҳиҖғжЁЎжӢҹиҜ•еҚ·е®Ңж•ҙзүҲ
- ж»Ғе·һеёӮ2019е№ҙй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғжөӢйӘҢеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- й«ҳдёҖдёӢеҶҢ第дёүж¬ЎжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢпјҲ2019-2020е№ҙж№–еҚ—зңҒйӮөдёңеҺҝ第дёҖдёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдәҢдёҠеҶҢ12жңҲжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲжұҹиӢҸзңҒжұҹйҳҙдёҖдёӯпјү
- жұҹиҘҝзңҒеҚ—жҳҢеёӮж–°е»әеҺҝ第дёҖдёӯеӯҰ2020еұҠй«ҳдёүдёҠжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰиҖғиҜ•