2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
某学生运用将一粒金属钠和一块铜片分别放在表面皿中,研究它们在空气中的稳定性。该学生采用的研究方法有 ①假说法 ②实验法 ③分类法 ④比较法 A.①② B.①③ C.②④ D.①③ |
|
| 2. | 详细信息 |
|
“阿波罗号飞船”所用的氢氧燃料电池的电极应为:负极:2H2+4OH--4e-=4H2O 正极 O2+2H2O+4e-=4OH- 该电池工作时,下列叙述正确的是 ( ) A.氢气发生还原反应 B.每转移4摩电子,电池内增加4摩水 C.负极附近溶液的PH值降低 D.正极附近C(H+)增大 |
|
| 3. | 详细信息 |
|
有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b;阴离子所带负电荷数的绝对值c<d,则四种元素核电荷数由小到大排列正确的是: A.d<c<a<b B.c<d<b<a C.d<a<b<c D.c<d<a<b |
|
| 4. | 详细信息 |
|
某气体通入品红溶液中,溶液褪色,加热后又恢复为原来颜色。该气体是 A.SO2 B.O2 C.CO2 D.H2 |
|
| 5. | 详细信息 |
|
25℃时,下列各物质的水溶液的p H小于7的是 A.Na2 CO3 B.KOH C.Fe2(SO4)3 D.KHCO3 |
|
| 6. | 详细信息 |
|
下列药品的保存方法正确的是 A、氢氟酸保存在橡皮塞的细口玻璃瓶中 B.钠可封存于固态石蜡中 C.烧碱溶液放在磨口玻璃塞的试剂瓶中 D.氯水密封于无色的试剂瓶中 |
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是 A.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中:CO2+SO2+4OH-=SO2-3+CO2-3+2H2O B.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ C.向Fe(NO3)3溶液中加入过量的HI溶液 2NO-3+8H++6I-=3I2+2NO↑+4H2O D.将等体积等物质的量浓度的NaHCO |
|
| 8. | 详细信息 |
|
将 A.与足量的NaOH溶液共热后,再通入CO2 B.溶液加热,通入足量的HCl C.与稀H2SO4共热后,加入足量的Na2CO3 D.与稀H2SO4共热后,加入足量的NaOH |
|
| 9. | 详细信息 |
|
下列说法正确的是 AHClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为:Fe3+ > Cu2+ > Fe2+ C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C-+ B2=2B-+C2都能发生 D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
|
| 10. | 详细信息 |
|
用质量均为100 g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28 g,此时两电极的质量分别为 A.阳极100 g,阴极128 g B.阳极93.6 g,阴极121.6 g C.阳极91.0 g,阴极119.0 g D.阳极86.0 g,阴极114.0 g |
|
| 11. | 详细信息 |
|
.化学反应N2+3H2
A.N2(g)+3H2(g) B.N2(g)+3H2(g) C.1/2N2(g)+ 3/2H2(g) D.1/2 N2(g)+3/2 H2(g) |
|
| 12. | 详细信息 |
|
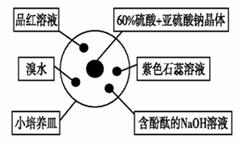
如图是研究二氧化硫性质的微型实验装置(密闭)。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,设生成的SO2足量,且不易污染空气。下列说法中错误的是
A.紫色石蕊溶液先变红色后褪色 B.品红溶液褪色 C.溴水橙色褪去 D.含酚酞的NaOH溶液红色褪去 |
|
| 13. | 详细信息 |
|
设NA表示阿伏加德罗常数,下列说法正确的是( ) A.1 mol NaHSO4晶体中离子总数为3NA B.2.24 L 14CH4分子中所含中子数为0.8NA C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA D.常温常压下,16gO2和O3混合气体含有NA个氧原子 |
|
| 14. | 详细信息 |
|
向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:
下列有关说法不正确的是( ) A.混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1 B.混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1 C.3号实验中沉淀的质量x为1.398 g D.完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL |
|
| 15. | 详细信息 | |||||||||||||||
|
预期目的是
A.A B.B C.C D.D |
||||||||||||||||
| 16. | 详细信息 | ||||||||
|
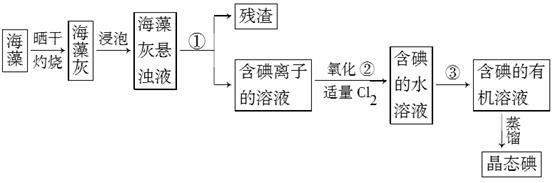
实验题: I.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为: Cl2+2KI===2KCl+I2。请回答下列问题:
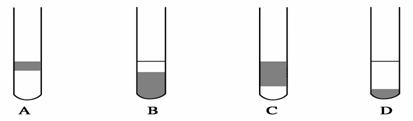
(1)指出提取碘的过程中有关实验操作①、③的名称:________;________。 (2)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是________。(注:如图试管中深色区为紫红色溶液)
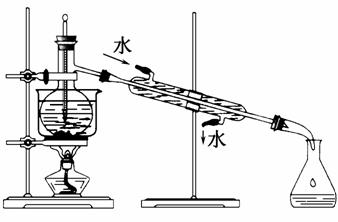
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图实验装置中的错误之处。(加热装置烧杯下已垫石棉网)
①________________________________________________; ②________________________________________________。 II.某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
(1)三次检测结果中第________次检测结果肯定不正确。 (2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子: 第一步:向溶液中滴加过量的①________溶液(填化学式),其目的是检验CO32-并将其除去; 第二步:加入②________溶液(填化学式),其目的是③_________________________ ________________________________________________________________________; 第三步:过滤,再向滤液中加入④________溶液(填化学式),其目的是⑤________________。 |
|||||||||
| 17. | 详细信息 |
|
钠、铝、铁、铜等金属及其化合物在社会生活的各个领域均有重要的应用。回答下列问题: (1)常温下将一定量的氯气通入石灰乳中,可制得漂白粉,其有效成分的化学式为___________;电解熔融态NaCl可以制得金属钠,反应的化学方程式为_____________。 (2)Au、Cu、Fe三种块状金属中,常温下能够全部溶于足量浓硝酸的是___________; Mg(OH)2、Al(OH)3、AgOH三种氢氧化物中,能溶于氨水的是______;硬铝是由Al、Cu、Mg、Si组成的铝合金,将硬铝废料投入氢氧化钠溶液中充分反应,溶液中含有的含氧酸根离子有___________。其中铝发生反应的离子方程式为______________。 (3)FeCl3溶液可以吸收烟气中的SO2,所得溶液能与软锰矿(主要成分为MnO2)反应生成硫酸锰(MnSO4),该反应的离子方程式为_______________。 (4)等浓度的Na2CO3、H2SO4、Ba(OH)2三种溶液,若以不同顺序将体积相等的三种溶液中的两种混合,若有沉淀先过滤,再将混合液与第三种溶液混合,最终所得的溶液不可能呈________(填“酸性”、“碱性”或“中性”)。 |
|
| 18. | 详细信息 |
|
实验室欲配制0.5 mol.L-l的NaOH溶液500 mL有以下仪器:①烧杯②分液漏斗③1 000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码) (1)配制时,必须使用的仪器有(填代号) ,还缺少的仪器是__________。 (2)需称量________g烧碱固体,固体应放在 中称量。 (3)使用容量瓶前必须进行的一步操作是 。 (4)在配制过程中,其他操作都正确,下列操作会引起误差偏高的是 。 ①未洗涤烧杯、玻璃棒 ②未等NaOH溶液冷却至室温就转移到容量瓶中 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤定容时仰视刻度线 ⑥NaOH用纸盛装进行称量 ⑦超过刻度线,吸出一部分水 ⑧摇匀后液面下降,补充水 |
|
| 19. | 详细信息 |
|
为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙两人分别选用下列试剂进行实验:0.01 mol·L—1氨水、0.1 mol·L—1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。 (1)甲用pH试纸测出0.01 mol·L—1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?____(填“是”或“否”),并说明理由。 (2)请你根据所提供的试剂,再提出一个合理又简便的方案,证明NH3·H2O是弱电解质。 |
|
| 20. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
滴定实验是化学学科中重要的定量实验。请回答下列问题: (1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。 ①下列操作会造成测定结果偏高的是 (填选项字母)。 A、滴定终点读数时,俯视滴定管刻度,其他操作正确 B、盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗 C、酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗 D、滴定前,滴定管尖嘴有气泡,滴定后气泡消失 ②某学生的实验操作如下: A、用碱式滴定管取稀NaOH溶液25.00 mL,注入锥形瓶中,加入甲基橙作指示剂 B、用待测定的溶液润洗碱式滴定管 C、用蒸馏水洗干净滴定管 D、取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下 E、检查滴定管是否漏水 F、另取锥形瓶,再重复操作一次 G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度 a.滴定操作的正确顺序是(用序号填写) 。 b.在G操作中如何确定终点? 。 (2)氧化还原滴定——取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,发生反应为: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+22MnSO4+8H2O。表格记录了实验数据:
①滴定时,KMnO4溶液应装在 (“酸”或“碱”)式滴定管中,达终点时的现象是 。 ②该草酸溶液的物质的量浓度为 。 (3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。 参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是 (填选项字母)。
A、NaCl B、NaBr C、NaCN D、Na2CrO4 |
|||||||||||||||||||||||||||||||||||||
| 21. | 详细信息 |
|
叶绿素在光的作用下可将CO2和H2O转化为葡萄糖(C6H12O6)和O2,6CO2+6H2O 科学家预言,在不久的将来,人类将模拟生物体内的这一变化过程,从工厂中由CO 2 和H 2 O直接生产出淀粉。这样,合成优质叶绿素将十分重要。 叶绿素有a、b两种,已知某种叶绿素中仅含有C、H、O、N、Mg五种元素,且知该叶绿素中各元素的质量分数分别是: w(C)=73.99% w(H)=8.072% w(O)=8.969% w(N)=6.278% w(Mg)=2.691% 经测定该叶绿素的相对分子质量小于1 000,试确定该叶绿素的分子式。 |
|
| 22. | 详细信息 |
|
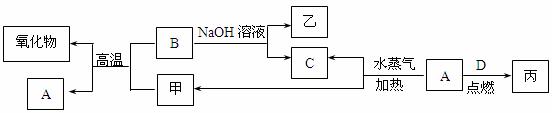
A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图的转化关系:
请回答下列问题: (1)B与甲反应的化学方程式是 。 B与NaOH溶液反应的离子方程式是 。 甲与足量盐酸溶液反应的离子方程式是 。 (2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。 (3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。 |
|
| 23. | 详细信息 |
|
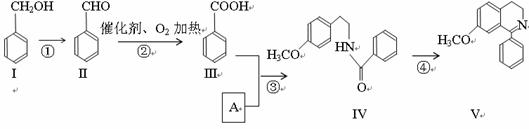
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
(1)Ⅱ中含氧官能团的名称 。 (2)反应②的化学方程式 。 (3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式 。 (4)下列说法正确的是 。 A.Ⅰ和Ⅴ均属于芳香烃 B.Ⅱ能发生银镜反应 C.Ⅱ能与4molH2发生加成反应 D.反应③属于酯化反应 (5)A的结构简式 。 (6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式 。 (7)一定条件下,化合物Ⅶ( |
|
| 24. | 详细信息 |
|
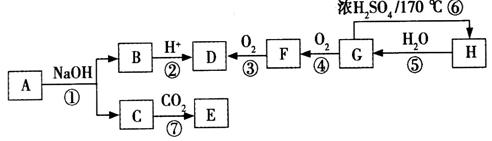
有机物A的相对分子质量小于150,其中含氧的质量分数为23.5%,完全燃烧只生成二氧化碳和水。有机物之间的相互转化如图(部分反应条件略)。 请回答下列问题: (1)H和F中含有的官能团的名称分别为:H中______________;F中________________。 (2)有机物E的结构简式为_______________________________。
(3)有机物G能发生的反应类型有____________________(填字母)。 A.取代反应 B.加成反应 C.消去反应 D.加聚反应 E.氧化反应 (4)以M表示有机物的摩尔质量,则下列关系正确的是______________(填字母)。 A.M(A) = M(B) + M(C) B.M(D) = M(G) + 14 C.2M(F) + 18 = M(D) + M(G) D.M(D) > M(F) > M(G) > M(H) (5)简述检验有机物F中的官能团的实验方法_______________________________________ ___________________________________________________________________________________________________________________________________________________________。 (6)写出反应①的化学方程式:_______________________________________________; 写出能验证苯酚和碳酸酸性 强弱的化学反应方程式: _____________________________。 |
|