2020еҢ—дә¬й«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁиҮӘжқҘж°ҙе…»йҮ‘йұјж—¶пјҢйҖҡеёёе…Ҳе°ҶиҮӘжқҘж°ҙз»Ҹж—Ҙжҷ’дёҖж®өж—¶й—ҙеҗҺпјҢеҶҚжіЁе…ҘйұјзјёпјҢе…¶зӣ®зҡ„жҳҜпјҲВ В В пјү A. еҲ©з”Ёзҙ«еӨ–зәҝжқҖжӯ»ж°ҙдёӯзҡ„з»ҶиҸҢВ В В В В В В В В В В В В В В В В В B. жҸҗй«ҳж°ҙжё©пјҢжңүеҲ©дәҺйҮ‘йұјз”ҹй•ҝ C. еўһеҠ ж°ҙдёӯж°§ж°”зҡ„еҗ«йҮҸВ В В В В В В В В В В В В В В В В В В В В В В В D. дҝғдҪҝж°ҙдёӯзҡ„ж¬Ўж°Ҝй…ёеҲҶи§Ј
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢеҲ—еҸҚеә”дёӯпјҢдәҢж°§еҢ–зўідҪңж°§еҢ–еүӮзҡ„жҳҜ(гҖҖгҖҖ) A. Ca(OH)2+CO2=CaCO3вҶ“+H2O B. CO2+C C. 2Fe2O3+3C D. C+2H2O(g)
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
вҖңз»ҝиүІеҢ–еӯҰвҖқи¶ҠжқҘи¶ҠеҸ—еҲ°дәә们зҡ„йҮҚи§ҶпјҢдёӢеҲ—зү©иҙЁеҸҜд»ҘзңӢдҪңз»ҝиүІж°§еҢ–еүӮзҡ„жҳҜ(гҖҖгҖҖ) A. жө“зЎ«й…ёВ В В В В В В В В В В В В B. жө“зӣҗй…ёВ В В В В В В В В В В В В C. еҸҢж°§ж°ҙВ В В В В В В В В В В В В D. ж°Ҝж°ҙ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪжӯЈзЎ®иЎЁзӨәдёӢеҲ—еҢ–еӯҰеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸзҡ„жҳҜ(гҖҖгҖҖ) A. ж°ўж°§еҢ–й’Ўжә¶ж¶ІдёҺзЁҖзЎқй…ёеҸҚеә”пјҡOH-+HпјӢ=H2O B. жҫ„жё…зҡ„зҹізҒ°ж°ҙдёҺзЁҖзӣҗй…ёеҸҚеә”пјҡCa(OH)2+2HпјӢ=Ca2пјӢ+2H2O C. йҶӢй…ёдёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”пјҡHпјӢ+OH-=H2O D. зўій…ёй’Ўжә¶дәҺзЁҖзӣҗй…ёдёӯпјҡCO32-+2HпјӢ=H2O+CO2вҶ‘
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫжүҖзӨәпјҢзәөеқҗж ҮиЎЁзӨәз”өеҜјзҺҮпјҢжЁӘеқҗж ҮиЎЁзӨәжүҖеҠ жә¶ж¶Ізҡ„йҮҸпјҢд»ҘдёӢеҗ„з»„еҸҚеә”з¬ҰеҗҲиҜҘеӣҫзҡ„жҳҜ(дёҚиҖғиҷ‘жә¶ж¶Іж··еҗҲдҪ“з§Ҝзҡ„еҸҳеҢ–)(гҖҖгҖҖ)
A. еҗ‘Ba(OH)2жә¶ж¶Ідёӯж»ҙеҠ зЁҖH2SO4 B. еҗ‘NaOHжә¶ж¶Ідёӯж»ҙеҠ зЁҖHCl C еҗ‘зәҜж°ҙдёӯеҠ е…ҘNaClжә¶ж¶І D. еҗ‘KClжә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶І
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй’ гҖҒй“қгҖҒй“ҒгҖҒй“ңе’Ңж°§ж°”зҡ„еҸҚеә”пјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. й“ҒеңЁж°§ж°”дёӯзҮғзғ§пјҢдә§зү©дёәеӣӣж°§еҢ–дёүй“Ғ B. й“қиЎЁйқўеҫҲе®№жҳ“иў«ж°§ж°”ж°§еҢ–пјҢз”ҹжҲҗиҮҙеҜҶзҡ„ж°§еҢ–зү©дҝқжҠӨиҶң C. й’ еёёжё©дёӢе’Ңж°§ж°”еҸҚеә”пјҢз”ҹжҲҗж·Ўй»„иүІзҡ„иҝҮж°§еҢ–й’ D. й“ңеҸҜд»ҘеңЁеҠ зғӯзҡ„жқЎд»¶дёӢе’Ңж°§ж°”еҸҚеә”пјҢз”ҹжҲҗж°§еҢ–й“ң
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
йҮ‘еұһеҚ•иҙЁеӣӣе…„ејҹWгҖҒXгҖҒYгҖҒZдёҚе°ҸеҝғжҺүеҲ°зЁҖзӣҗй…ёжұ дёӯпјҢеҸҚеә”еҰӮеӣҫжүҖзӨәпјҢеҲҷе®ғ们зҡ„жҙ»еҠЁжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸжҳҜ(гҖҖгҖҖ)
A. XпјһWпјһZпјһYВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В B. ZпјһXпјһWпјһY C. WпјһXпјһYпјһZВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В D. YпјһZпјһXпјһW
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁж°ҙжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ(гҖҖгҖҖ) A. еҗ«жңүеӨ§йҮҸ Ba2пјӢзҡ„жә¶ж¶ІдёӯпјҡClпјҚгҖҒKпјӢгҖҒSO42пјҚгҖҒCO32пјҚ B. еҗ«жңүеӨ§йҮҸHпјӢзҡ„жә¶ж¶ІдёӯпјҡMg2пјӢгҖҒNaпјӢгҖҒSO42пјҚгҖҒHCO3пјҚ C. еҗ«жңүеӨ§йҮҸOHпјҚзҡ„жә¶ж¶ІдёӯпјҡMg2пјӢгҖҒNO3пјҚгҖҒSO42пјҚгҖҒCO32пјҚ D. еҗ«жңүеӨ§йҮҸNaпјӢ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A. еӨұз”өеӯҗи¶ҠеӨҡпјҢиҝҳеҺҹжҖ§и¶ҠејәпјҢеҫ—з”өеӯҗи¶ҠеӨҡпјҢж°§еҢ–жҖ§и¶Ҡејә B. 2Fe3++Cu=2Fe2++Cu2+пјҢжӯӨеҸҚеә”дёӯж°§еҢ–жҖ§пјҡCu>Fe2+ C. SO42-дёӯзҡ„зЎ«еҺҹеӯҗеҢ–еҗҲд»·жҳҜ+6д»·пјҢеӨ„дәҺзЎ«зҡ„жңҖй«ҳд»·пјҢеӣ жӯӨSO42-ж°§еҢ–жҖ§дёҖе®ҡеҫҲејә D. ж°§еҢ–жҖ§ејәејұзҡ„йЎәеәҸдёәпјӣZ2>A3+пјҢеҲҷжә¶ж¶ІдёӯеҸҜеҸ‘з”ҹпјҡZ2+2A2+=2A3++2Z-
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | |
|
еҰӮеӣҫжҳҜзЎ«й…ёиҜ•еүӮ瓶ж ҮзӯҫдёҠзҡ„йғЁеҲҶеҶ…е®№гҖӮжҚ®жӯӨдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
A. H2SO4зҡ„ж‘©е°”иҙЁйҮҸдёә98g B. иҜҘзЎ«й…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә9.2molВ·LпјҚ1 C. й…ҚеҲ¶250mL4.6molВ·LпјҚ1зҡ„зЁҖзЎ«й…ёйңҖеҸ–иҜҘзЎ«й…ё62.5mL D. иӢҘдёҚе°Ҹеҝғе°ҶиҜҘзЎ«й…ёжә…еҲ°зҡ®иӮӨдёҠпјҢеә”з«ӢеҚіз”ЁNaOHжә¶ж¶ІеҶІжҙ—
|
||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
иҝҗз”Ёе…ғзҙ е‘ЁжңҹеҫӢеҲҶжһҗдёӢйқўзҡ„жҺЁж–ӯпјҢе…¶дёӯдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. й”Ӯ(Li)дёҺж°ҙеҸҚеә”жҜ”й’ дёҺж°ҙеҸҚеә”еү§зғҲ B. з №(At)дёәжңүиүІеӣәдҪ“пјҢAgAtйҡҫжә¶дәҺж°ҙд№ҹдёҚжә¶дәҺзЁҖзЎқй…ё C. еңЁж°§ж°”дёӯпјҢй“·(Rb)зҡ„зҮғзғ§дә§зү©жҜ”й’ зҡ„зҮғзғ§дә§зү©жӣҙеӨҚжқӮ D. HBrO4зҡ„й…ёжҖ§жҜ”HIO4зҡ„й…ёжҖ§ејә
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
еҮ з§ҚдёҚеҗҢе‘Ёжңҹзҡ„зҹӯе‘Ёжңҹе…ғзҙ зҡ„еҺҹеӯҗеҚҠеҫ„еҸҠдё»иҰҒеҢ–еҗҲд»·еҰӮдёӢиЎЁпјҡ
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. XгҖҒYе…ғзҙ зҡ„йҮ‘еұһжҖ§пјҡX<Y B. Yзҡ„еҚ•иҙЁеҸӘиғҪдёҺејәй…ёеҸҚеә” C. еӣӣз§Қе…ғзҙ еҪўжҲҗзҡ„з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„пјҡZпјҚ>XпјӢ>Y3пјӢ>W2пјҚ D. Zзҡ„еҚ•иҙЁдёҺXзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©еҸҚеә”зҡ„дә§зү©д№ӢдёҖе…·жңүжјӮзҷҪжҖ§
|
||||||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫжҳҜжҹҗе„ҝз«Ҙеҫ®йҮҸе…ғзҙ дҪ“жЈҖжҠҘе‘ҠеҚ•зҡ„йғЁеҲҶж•°жҚ®пјҡ
ж №жҚ®дёҠиЎЁ пјҲ1пјүиҜҘе„ҝз«ҘВ В В В В В В В В е…ғзҙ еҗ«йҮҸеҒҸдҪҺгҖӮ пјҲ2пјүжҠҘе‘ҠеҚ•дёӯвҖңОјmol/LвҖқжҳҜВ В В В В В В В В В пјҲеЎ«вҖңиҙЁйҮҸвҖқгҖҒвҖңдҪ“з§ҜвҖқжҲ–вҖңжө“еәҰвҖқпјүзҡ„еҚ•дҪҚгҖӮ пјҲ3пјүжңҚз”Ёз»ҙз”ҹзҙ CеҸҜдҪҝйЈҹзү©дёӯзҡ„Fe3+иҪ¬еҢ–дёәFe2+гҖӮеңЁиҝҷдёӘиҝҮзЁӢдёӯдҪ“зҺ°з»ҙз”ҹзҙ Cзҡ„В В В В В В В В пјҲеЎ«вҖңж°§еҢ–жҖ§вҖқжҲ–вҖңиҝҳеҺҹжҖ§вҖқпјүгҖӮ пјҲ4пјүзјәй“ҒжҖ§иҙ«иЎҖжӮЈиҖ…еә”иЎҘе……Fe2+гҖӮдёҖдәӣиЎҘй“ҒеүӮд»ҘзЎ«й…ёдәҡй“Ғдёәдё»иҰҒжҲҗеҲҶпјҢз”ЁзЎ«й…ёдәҡй“ҒеҲ¶жҲҗиҚҜзүҮж—¶еӨ–иЎЁеҢ…жңүдёҖеұӮзү№ж®Ҡзҡ„зі–иЎЈпјҢжҺЁжөӢзі–иЎЈзҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёәдҝқжҢҒиЎ—йҒ“ж•ҙжҙҒгҖҒж№ҝж¶Ұ,еңЁи·ҜйқўжҲ–е№ҝеңәдёҠе–·жҙ’еҗ«еҢ–еӯҰејҸдёәXY2зҡ„жә¶ж¶ІдҪңдҝқж№ҝеүӮгҖӮXеҺҹеӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫдёә (1)m=гҖҖгҖҖгҖҖгҖҖ,иҜҘдҝқж№ҝеүӮзҡ„еҢ–еӯҰејҸдёәгҖҖгҖҖгҖҖгҖҖ (2)ZгҖҒWе…ғзҙ зҡ„еҗҚз§°дёәгҖҖгҖҖгҖҖгҖҖгҖҒгҖҖгҖҖгҖҖгҖҖ (3)дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜгҖҖгҖҖгҖҖгҖҖ A.XY2е’ҢWZ2йғҪдёәзҰ»еӯҗеҢ–еҗҲзү© B.XY2дёӯд»…еҗ«зҰ»еӯҗй”®,WZ2дёӯд»…еҗ«жһҒжҖ§е…ұд»·й”® C.H2ZжҜ”HYзҡ„зЁіе®ҡжҖ§ејә D.Xзҡ„йҳізҰ»еӯҗжҜ”Yзҡ„йҳҙзҰ»еӯҗеҚҠеҫ„еӨ§ (4)дёӢеҲ—еҢ–еӯҰз”ЁиҜӯиЎЁиҫҫжӯЈзЎ®зҡ„жҳҜгҖҖгҖҖгҖҖгҖҖ A.XY2зҡ„з”өеӯҗејҸ:X2+ B.WZ2зҡ„з»“жһ„ејҸ:Z=W=Z C.Yе…ғзҙ зҡ„еҚ•иҙЁдёҺH2Zж°ҙжә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә:Y2+Z2- D.з”Ёз”өеӯҗејҸиЎЁзӨәXY2зҡ„еҪўжҲҗиҝҮзЁӢдёә:
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
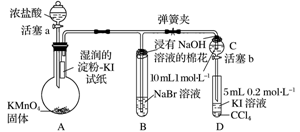
жҹҗеҢ–еӯҰиҜҫеӨ–е…ҙи¶Је°Ҹз»„дёәйӘҢиҜҒеҚӨзҙ еҚ•иҙЁж°§еҢ–жҖ§зҡ„зӣёеҜ№ејәејұпјҢз”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢе®һйӘҢ(еӨ№жҢҒд»ӘеҷЁе·Із•ҘеҺ»пјҢж°”еҜҶжҖ§е·ІжЈҖйӘҢ)гҖӮ
е®һйӘҢиҝҮзЁӢпјҡ в… .жү“ејҖеј№з°§еӨ№пјҢжү“ејҖжҙ»еЎһaпјҢж»ҙеҠ жө“зӣҗй…ёгҖӮ в…Ў.еҪ“Bе’ҢCдёӯзҡ„жә¶ж¶ІйғҪеҸҳдёәй»„иүІж—¶пјҢеӨ№зҙ§еј№з°§еӨ№гҖӮ в…ў.еҪ“Bдёӯжә¶ж¶Із”ұй»„иүІеҸҳдёәзәўжЈ•иүІж—¶пјҢе…ій—ӯжҙ»еЎһaгҖӮ в…Ј. вҖҰвҖҰ (1)зӣӣж”ҫжө“зӣҗй…ёзҡ„д»ӘеҷЁеҗҚз§°дёә____________________гҖӮ (2)еңЁзғ§з“¶еҶ…еҸ‘з”ҹеҸҚеә”ж—¶пјҢдҪ“зҺ°жө“зӣҗй…ёзҡ„жҖ§иҙЁдёә__________________гҖӮ (3)йӘҢиҜҒж°Ҝж°”зҡ„ж°§еҢ–жҖ§ејәдәҺзўҳзҡ„е®һйӘҢзҺ°иұЎжҳҜ__________________________гҖӮ (4)Bдёӯжә¶ж¶ІеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ____________________________гҖӮ (5)жөёжңүNaOHжә¶ж¶Ізҡ„жЈүиҠұзҡ„дҪңз”Ёдёә______________________________гҖӮ (6)дёәйӘҢиҜҒжәҙзҡ„ж°§еҢ–жҖ§ејәдәҺзўҳпјҢиҝҮзЁӢв…Јзҡ„ж“ҚдҪңжӯҘйӘӨе’ҢзҺ°иұЎжҳҜ______________гҖӮ (7)иҝҮзЁӢв…ўе®һйӘҢзҡ„зӣ®зҡ„жҳҜ________________________________гҖӮ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®ӨжңүеҢ–еӯҰзәҜзҡ„жө“зЎ«й…ёпјҢе…¶иҜ•еүӮ瓶ж ҮзӯҫдёҠзҡ„йғЁеҲҶеҶ…е®№еҰӮдёӢеӣҫпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүй…ҚеҲ¶жә¶ж¶Іж—¶пјҢдёҖиҲ¬еҸҜд»ҘеҲҶдёәд»ҘдёӢеҮ дёӘдё»иҰҒжӯҘйӘӨпјҡ в‘ йҮҸеҸ–В в‘Ўи®Ўз®—В в‘ўжә¶и§ЈВ в‘Је®ҡе®№В в‘ӨиҪ¬з§»В в‘Ҙжҙ—ж¶ӨВ в‘Ұ装瓶пјҢе…¶жӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸдёә___________пјҲеЎ«еәҸеҸ·пјүгҖӮ пјҲ2пјүе®һйӘҢе®ӨеҸӘжңү100В mLгҖҒ250В mLгҖҒ500В mLдёүз§Қи§„ж јзҡ„е®№йҮҸ瓶пјҢдҪҶиҰҒй…ҚеҲ¶480 mL 0.50 mol/Lзҡ„зЁҖзЎ«й…ёпјҢйңҖеҸ–иҜҘжө“зЎ«й…ё______mLгҖӮ пјҲ3пјүжҺҘдёӢжқҘе®ҢжҲҗжӯӨе®һйӘҢдҪ е°Ҷз”ЁеҲ°зҡ„д»ӘеҷЁжңү20В mLйҮҸзӯ’гҖҒзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒ____________гҖӮ пјҲ4пјүиҰҒд»ҺжүҖй…Қжә¶ж¶ІдёӯеҸ–еҮә50 mLзӣӣиЈ…дәҺиҜ•еүӮ瓶дёӯпјҢз»ҷе®ғиҙҙдёҠж ҮзӯҫпјҢеҲҷж Үзӯҫзҡ„еҶ…е®№жҳҜ________________пјӣиӢҘеҶҚд»ҺдёӯеҸ–еҮә10 mLжә¶ж¶ІзЁҖйҮҠиҮі20 mLпјҢеҲҷзЁҖйҮҠеҗҺжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә__________гҖӮ пјҲ5пјүдёӢеҲ—ж“ҚдҪңдјҡдҪҝжүҖй…Қжә¶ж¶Іжө“еәҰеҒҸдҪҺзҡ„жҳҜ__________гҖӮ A. з”ЁйҮҸзӯ’йҮҸеҸ–жө“зЎ«й…ёпјҢиҜ»ж•°ж—¶д»°и§ҶеҲ»еәҰзәҝВ В В В B. иҪ¬з§»жә¶ж¶Іж—¶жңӘжҙ—ж¶Өзғ§жқҜ C. е®№йҮҸ瓶用蒸йҰҸж°ҙжҙ—еҮҖеҗҺд»Қж®Ӣз•ҷжңүи’ёйҰҸж°ҙВ В В В D. е®ҡе®№ж—¶дҝҜи§Ҷе®№йҮҸ瓶зҡ„еҲ»еәҰзәҝ E. е®ҡе®№ж‘ҮеҢҖеҗҺпјҢеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢеҶҚеҠ ж°ҙиҮіеҲ»еәҰзәҝ
|
|
- и•үеІӯеҺҝи•үеІӯдёӯеӯҰ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғжөӢйӘҢзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- зҰҸе·һеёӮ2020е№ҙй«ҳдәҢеҢ–еӯҰдёҠеӯҰжңҹжңҹжң«иҖғиҜ•еёҰзӯ”жЎҲдёҺи§Јжһҗ
- 2018иҮі2019е№ҙй«ҳдёҖдёӢжңҹжңҹжң«иҒ”иҖғеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲжұҹиӢҸзңҒеҚ—дә¬еёӮе…ӯж ЎиҒ”еҗҲдҪ“пјү
- 2018-2019е№ҙй«ҳдәҢдёӢеҶҢ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰдё“йўҳи®ӯз»ғпјҲжөҷжұҹзңҒжё©е·һеёӮжұӮзҹҘдёӯеӯҰпјү
- з•ҢйҰ–еёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҲ·йўҳи®ӯз»ғ
- 2020е№ҙ10жңҲжұҹиӢҸиӢҸе·һеёӮеӣӯеҢәжҳҹжө·дёӯеӯҰй«ҳдёҖдёҠеҚҠжңҹжңҲиҖғеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№ .
- йҷ•иҘҝзңҒиҘҝе®үеёӮй•ҝе®үеҢә第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- жұҹиӢҸзңҒж·®йҳҙдёӯеӯҰ2021еұҠй«ҳдёүдёҠжңҹејҖеӯҰз»ғд№ еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·