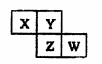2016高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列分散系中,分散质微粒半径最小的是 A、雾 B、KCl溶液 C、蛋白质 D、新制Cu(OH)2悬浊液
|
|
| 2. | 详细信息 |
|
下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是 A.甲苯 B.聚丙烯 C.丁烯 D.乙烯
|
|
| 3. | 详细信息 |
|
等物质的量的下列有机物充分燃烧时,消耗氧气最多的是 A.甲烷 B.乙烯 C.苯 D.乙醇
|
|
| 4. | 详细信息 |
|
氢核磁共振谱是根据不同化学环境的氢原子在谱中给出的信号不同来确定有机物分子中氢原子种类的。下列有机物分子中,在氢核磁共振谱中只给出一种信号的是( ) A.丙烷 B.新戊烷 C.正丁烷 D.异丁烷
|
|
| 5. | 详细信息 |
|
制取一氯乙烷,采用的最佳方法是 A.乙烷和氯气取代反应 B.乙烯和氯气加成反应 C.乙烷和HCl作用 D.乙烯和HCl加成反应
|
|
| 6. | 详细信息 |
|
对碱金属元素,随着核电荷数的增大,下列说法中正确的是( ) A.原子半径依次增大,离子半径依次减小 B.单质的熔点、沸点依次降低 C.氧化物对应的水化物碱性依次增强 D.单质的还原性依次减弱
|
|
| 7. | 详细信息 |
|
下列说法不正确的是 A.胶体一定是混合物 B.胶体粒子的直径在1~100 nm之间 C.丁达尔效应可用于鉴别胶体和溶液 D.将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体
|
|
| 8. | 详细信息 |
|
一定温度下在容积恒定的密闭容器中,进行可逆反应: A(s)+2B(g) ①容器内气体的压强 ②混合气体的密度 ③混合气体的平均相对分子质量 ④B的物质的量 A.只有④ B.②③ C.②③④ D.①④
|
|
| 9. | 详细信息 |
|
由乙烯推测丙烯的结构或性质正确的是 A. 分子中3个碳原子在同一直线上 B.分子中所有原子在同一平面上 C.与氯化氢加成只生成一种产物 D.能使酸性高锰酸钾溶液褪色
|
|
| 10. | 详细信息 |
|
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g) A.x的值为1 B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1 C.反应开始前A的物质的量为3 mol D.5 min时A的浓度为0.2 mol·L-1
|
|
| 11. | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )。 A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA B.1 mol Na2CO3晶体中含CO32—离子数小于1NA C.惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体 11.2 L D.0.1 mol的CaO2中含阴离子数是0.2NA
|
|
| 12. | 详细信息 |
|
下列做法与盐类水解知识无关的是 A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 B.施肥时,草木灰(有效成分为 K2CO3)不能与碳酸氢铵混合使用 C.Al2S3不能用复分解反应的方法在溶液中制取,而只能用干法制备。 D.配制 FeCl2溶液时常常要在溶液中加入少量铁粉
|
|
| 13. | 详细信息 |
|
下列说法正确的是 A.常温下,反应C(s)+CO2(g) B.自发反应的熵一定增大,非自发反应的熵一定减小 C.凡是放热反应都是自发的,因为吸热反应都是非自发的 D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
|
|
| 14. | 详细信息 |
|
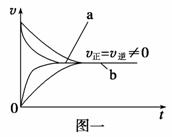
下列说法中正确的是 ( )
A.Na2S2O3+2HCl B.若在恒容容器中发生反应:N2+3H2 C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 D.若在恒压容器中发生反应:2SO3
|
|
| 15. | 详细信息 |
|
X、Y、Z、W均为短周期元素,在周期表中位置如图所示。
Y原子的最外层电子数是电子层数的3倍。下列说法中不正确的是 ( ) A.Y、Z的气态氢化物,前者更稳定 B.z、w的最高价氧化物对应水化物的酸性,前者强 C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键 D.Y、W的单质,均可通过电解的方法获得
|
|
| 16. | 详细信息 |
|
按照要求,回答下列问题 (1)写出下列物质熔融态的电离方程式:NaHSO4 。 (2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。滴加Na2CO3溶液时发生反应的化学方程式为 。 (3)写出制备Fe(OH)3胶体的化学方程式:__________ __。取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中逐渐滴加稀盐酸至过量,发生此变化的离子方程式为___________ ____。
|
|
| 17. | 详细信息 |
|
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO=CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入足量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。 (1)原混合气体的物质的量是____________;生成沉淀的摩尔质量是____________。 (2)求原混合气体中甲烷及氮气体积。
|
|
| 18. | 详细信息 |
|
实验室配制500ml 2mol·L-1的H2SO4溶液 (1)所需仪器应该有容量瓶、玻璃棒、量筒、________________、________________。 (2)容量瓶在使用前,首先应检查 。 (3)此实验中,玻璃棒的两个作用分别是________________、________________。 (4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸_____________ml。 (5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水_________(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响____________。(填“有影响”或“无影响”)
|
|
| 19. | 详细信息 |
|
有一包白色固体粉末,由Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的三种物质组成,取样进行如下实验: I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液; II.向I中滤出的沉淀中加入足量稀盐酸,沉淀全溶解,并生产无色气体。 (1)则原混合物中一定不存在 ,一定存在 。 (2)实验中发生反应的化学方程式: 。 (3)设计实验进一步确定混合物的组成,简述实验步骤、现象和结论。 。
|
|
| 20. | 详细信息 | ||||||||||||||||||
|
为测定硫酸亚铁铵晶体【(NH4)2Fe (SO4)2 · xH2O】中铁的含量,某实验小组做了如下实验: 步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液。 步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+。 再重复步骤二两次。 请回答下列问题: (1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、 、转移、洗涤并转移、 、摇匀。 (2)用 滴定管盛放KMnO4溶液。 (3)当滴入最后一滴KMnO4溶液,出现 ,即到达滴定终点。反应的离子方程式: (4)滴定结果如下表所示:
实验测得该晶体中铁的质量分数为 。(保留两位小数) (5)根据步骤二填空: ①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将 。(填“偏高”、“偏低”或“无影响”)。 ②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将 (填“偏大”、“偏小”或“无影响”)。 ③滴定时边滴边摇动锥形瓶,眼睛应观察 。 A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化 ④滴定后俯视读数,测得样品中铁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
|
|||||||||||||||||||
| 21. | 详细信息 |
|
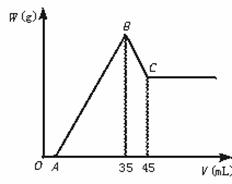
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛100 mL某浓度的H2SO4溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的质量W与加入NaOH溶液的体积V的关系如图所示。
求(1)H2SO4溶液的物质的量浓度是多少? (2)若A=2.3 mL,铝土矿中Al2O3的质量百分含量是多少?
|
|
| 22. | 详细信息 |
|
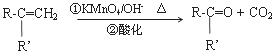
已知:R-CH=CH-O-R′(烃基烯基醚)
请回答下列问题: (1)A的结构简式为____________ ; B的名称是______________ ; (2)写出C → D反应的化学方程式:____________________ ; (3)写出同时符合下列条件:① 属于芳香醛;② 苯环上有两种不同环境的氢原子E的任意一种同分异构体的结构简式:______________ 。
|
|
| 23. | 详细信息 |
|
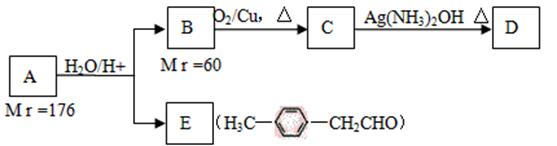
已知: 有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3mol CO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。
请回答: (1) A的分子式是 。 (2)1mol B与足量的金属钠反应产生22.4L(标准状况)H2。B中所含官能团的名称是 。B与C的相对分子质量之差为4,B→C的化学方程式是 。 (3) D的同分异构体G所含官能团与D相同,则G的结构简式可能是 、 。 (4)F可发生多种类型的反应。 ①两分子F反应生成的六元环状酯类化合物的结构简式是 ; ②由F可生成使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是 。 ③F在一定条件下发生缩聚反应的化学方程式是 。 (5)A的结构简式是 。
|
|
| 24. | 详细信息 |
|
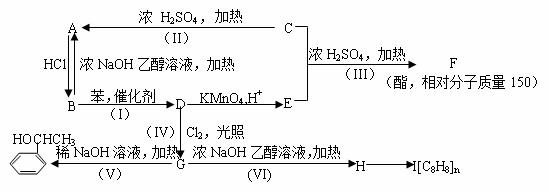
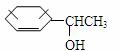
根据以下转化关系(所有无机产物均已略去)。回答下列各问:
(1)在编号(I)~(VI)的六个反应中,属于取代反应的有(填反应编号) 。 (2)写出指定物质的结构简式:F ;I 。 (3)写出下列反应的化学方程式: B转化为D的化学方程式: 。 G转化为H的化学方程式: 。 (4)
|
|