2017高二下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是 ( ) A. 加热 B. 将稀硫酸改为98%的浓硫酸
|
|
| 2. | 详细信息 |
|
可逆反应2NO2 A. 单位时间内生成n mol O2的同时生成2n mol NO2 B. 反应容器内,物质的分子总数不随时间的变化而变化 C. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1 D. 混合气体的颜色不再改变的状态
|
|
| 3. | 详细信息 |
|
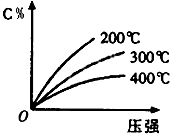
反应mA(固)+nB(气)
A. 到平衡后,加入催化剂C%不变 B. 达到平衡后,若升温,平衡右移 C. 化学方程式中n<e+f D. 达到平衡后,增加A的质量有利于平衡向右移动
|
|
| 4. | 详细信息 |
|
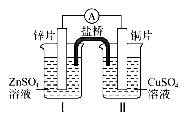
铜锌原电池(如图)工作时,下列叙述正确的是( )
A. 正极反应为:Zn-2e-=Zn2+ B. 盐桥中的K+移向ZnSO4溶液 C. 电池反应为:Zn+Cu2+=Zn2++Cu D. 在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极
|
|
| 5. | 详细信息 |
|
某原电池的电池反应为:Fe+2Fe3+ == 3Fe2+,与此电池反应不符的原电池是( ) A. 铜片、铁片、FeCl3溶液组成的原电池 B. 石墨、铁片、Fe(NO3)3溶液组成的原电池 C. 铁片、锌片、Fe2(SO4)3溶液组成的原电池 D. 银片、铁片、Fe(NO3)3溶液组成的原电池
|
|
| 6. | 详细信息 | ||||||||||||||||||||
|
关于强弱电解质及非电解质的组合完全正确的是( )
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 7. | 详细信息 |
|
氨水有下列平衡:NH3·H2O A. 加NaOH B. 加盐酸 C. 加NH4Cl D. 加热
|
|
| 8. | 详细信息 |
|
下列溶液一定呈中性的是( ) A. pH=7的溶液 B. c(H+)=c(OH-)=10-6mol/L溶液 C. 使石蕊试液呈紫色的溶液 D. 酸与碱恰好完全反应生成正盐的溶液
|
|
| 9. | 详细信息 |
|
已知在Ca3(PO4)2的饱和溶液中,c(Ca2+)=2.0×10-6mol.L-1,C(PO43-)=1.58×10-6mol.L-1,则Ca3(PO4)2的Ksp为( ) A. 2.0×10-29 B. 3.2×10-12 C. 6.3×10-18 D. 5.1×10-27
|
|
| 10. | 详细信息 | ||||||||
|
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
由上述数据可知,选用的沉淀剂最好为( ) A. 硫酸盐 B. 硫化物 C. 碳酸盐 D. 以上沉淀剂均可
|
|||||||||
| 11. | 详细信息 |
|
已知在室温时纯水中存在电离平衡:H2O A. 向水中加入少量NH4Cl,由水电离出的c(H+)>1×10-7mol/L B. 升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性 C. 向水中加入氨水,平衡逆向移动,水的电离受到抑制,所以c(OH-)降低 D. 向水中加入少量硫酸,c(H+)增大,所以由水电离出的c(H+)>1×10-7mol/L
|
|
| 12. | 详细信息 |
|
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是( ) A. K+、Ba2+、Cl–、NO3– B. Na+、Ca2+、Fe2+、NO3– C. NH4+、Al3+、Br–、SO42– D. K+、Na+、HCO3–、SO42–
|
|
| 13. | 详细信息 |
|
下列叙述正确的是( ) A. 95℃时纯水的pH<7,说明加热可导致水呈酸性 B. 将pH=3的CH3COOH溶液加水稀释10倍后pH=4 C. 0.2mol/L的盐酸1L加水到2L后,溶液的pH=1 D. NaHCO3 溶液水解反应的方程式:HCO3-+H2O
|
|
| 14. | 详细信息 |
|
下列溶液加热蒸干后,能析出溶质固体的是( ) A. AlCl3 B. KHCO3 C. NH4HCO3 D. Fe2(SO4)3
|
|
| 15. | 详细信息 |
|
温度相同、浓度均为0.1mol•L-1的:①(NH4)2SO4、②NH4HCO3、③NH4HSO4、④NH4NO3、溶液,它们的c(NH4+)由小到大的排列顺序是( ) A. ②④③① B. ③①④② C. ③②①④ D. ②④①③
|
|
| 16. | 详细信息 |
|
0.1 mol/L K2CO3溶液中,若使c(CO32-)更接近0.1 mol/L,可采取的措施是( ) A. 加入少量盐酸 B. 加KOH固体 C. 加水 D. 加热
|
|
| 17. | 详细信息 |
|
物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( ) A. KX、KZ、KY B. KX、 KY、KZ C. KZ、KY 、KX D. KY、KZ、KX
|
|
| 18. | 详细信息 |
|
室温时,下列混合溶液的pH一定小于7的是( ) A. pH=3的盐酸和pH=11的氨水等体积混合 B. pH=3的盐酸和 pH=11的氢氧化钡溶液等体积混合 C. pH=3的硫酸和 pH=11的氨水等体积混合 D. pH=3的醋酸和 pH=11 的氢氧化钡溶液等体积混合
|
|
| 19. | 详细信息 |
|
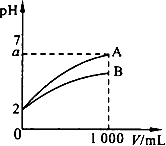
pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。
下列说法正确的是( ) A. A、B两酸溶液的物质的量浓度一定相等 B. 稀释后,A酸溶液的酸性比B酸溶液强 C. a=5时,A是强酸,B是弱酸 D. 若A、B都是弱酸,则5≥a>2
|
|
| 20. | 详细信息 |
|
对于3Fe(s)+4H2O(g) A. K= C. K=
|
|
| 21. | 详细信息 |
|
用中和滴定法测定某烧碱样品的纯度.有以下步骤: (1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液. (2)滴定过程: ①盛装0.10mol/L的盐酸标准液应该使用________滴定管; ②滴定时双眼应注意观察_________________________; (3)误差讨论:(选填“偏高”、“偏低”或“无影响”) ①用蒸馏水冲洗锥形瓶,测定结果__________; ②装标准液之前,没有用标准液润洗滴定管,测定结果__________; ③读数时,滴定前仰视,滴定后俯视,测定结果__________;
|
|
| 22. | 详细信息 |
|
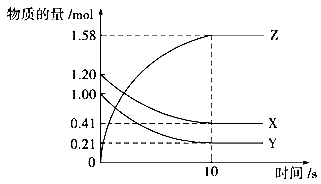
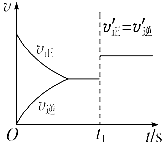
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图: 回答下列问题: (1)从反应开始到10s时,用Z表示的反应速率为_______, X的物质的量浓度减少了___________,Y的转化率为______________。 (2)该反应的化学方程式为_________________________。 (3) 10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______________。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度 C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
|
|
| 23. | 详细信息 |
|
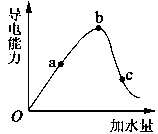
下图是在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力与加水量的关系。回答下列问题:
(1)0”点导电能力为0的理由__________________________________; (2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________________; (3)a、b、c三点中,醋酸的电离程度最大的一点是_____________; (4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________; A.加热 B.加水 C.加CH3COONa固体 D.加很稀的NaOH溶液 (5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是____________。 A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
|
|
| 24. | 详细信息 |
|
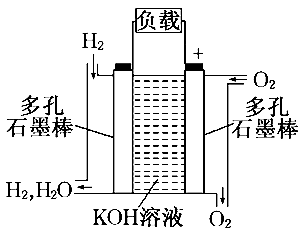
(1)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得),若1 mol水蒸气转化为液态水放出的热量为45kJ,则反应H2(g) + (3)下图为氢氧燃料电池的结构示意图,当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: ①图中通过负载的电子流动方向_______ (填“向左”或“向右”). 负极发生_____________反应; ②写出氢氧燃料电池工作时电极反应式负极:________________________________,正极:___________________________。
|
|