2019高二上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列说法正确的是: A.能自发进行的反应都是放热反应 B.硝酸铵溶于水是熵增加的过程 C.工业合成氨的反应是熵增加反应 D.碳酸钙受热分解在任何温度下均不能自发进行
|
|
| 2. | 详细信息 |
|
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。 (1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为 P4(s,白磷)+5O2(g)===P4O10(s)ΔH1=-2983.2kJ·mol-1 P(s,红磷)+ 则该温度下红磷转化为白磷的热化学方程式为 (2)已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638kJ·mol-1。在某密闭容器中加入37.2g白磷和29.12L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为
|
|
| 3. | 详细信息 |
|
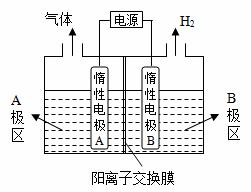
电解原理在化学工业中有广泛应用。(1)氯碱厂电解饱和食盐水制取烧碱,若利用下图装置制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
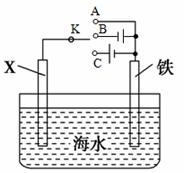
②阳极电极反应式为 ,电解过程中Na+向 电极迁移(填“A”或“B”) ③电解总反应的离子方程式是 (2)利用下图装置,可以模拟铁的电化学防护 ①若X为碳电极,为减缓铁的腐蚀,开关K应置于 处(填“A”、“B”或“C”)
②若X为锌电极,开关K置于A处,该电化学防护法称为
|
|
| 4. | 详细信息 |
|
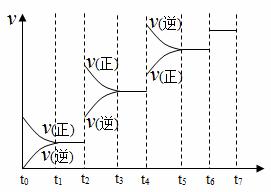
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) (1)该反应的还原剂是 ,其还原产物:氧化产物之比为 (2)该反应的平衡常数表达式为K= (3)若升高温度CO的浓度增大,则其焓变△H 0(填“>”、“<”或“=”);若降低温度,其平衡常数值将 (填“增大”、“减小”或“不变”);已知CO生成速率为v(CO)=9mol•L-1•min-1,则N2消耗速率为v(N2)= (4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t6时改变的条件可能是 ;图中表示平衡时N2转化率最高的一段时间是
|
|
| 5. | 详细信息 | ||||||||||||||||||||||||||
|
某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素。 实验药品:1.0moL/L盐酸、2.0mol/L盐酸、1.0mol/L硫酸、2.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为25.0mL,金属用量均为6.0g。 (1)帮助该组同学完成以上实验设计表。
(2)该小组同学在对比①和⑤实验时发现①的反应速率明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?
|
|||||||||||||||||||||||||||
| 6. | 详细信息 |
|
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是: A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑ B.钢铁发生电化学腐蚀时负极反应式为Fe-2e-===Fe2+ C.粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=== Cu D.氢氧燃料电池的负极反应式为O2+2H2O+4e-===4OH-
|
|
| 7. | 详细信息 |
|
下列影响因素中,既能改变化学反应速率,又能改变化学平衡常数的是: A.催化剂 B. 浓度 C. 温度 D. 固体表面积大小
|
|
| 8. | 详细信息 | |||||||||||||||||||||||||
|
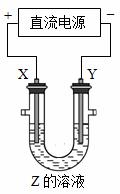
用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是:
|
||||||||||||||||||||||||||
| 9. | 详细信息 |
|
在298K,101KPa时,16g硫粉在氧气中充分燃烧放出149.8kJ的热量,则下列热化学方程式正确的是: A.S(s)+O2(g)= SO2(g) ΔH=-299.6kJ/mol B.2S(s)+2O2(g)=2SO2(g) ΔH=+599.2kJ/mol C.S(s)+O2(g)= SO2(g) ΔH=+299.6kJ/mol D.2S(s)+2O2(g)= 2SO2(g) ΔH=-299.6kJ/mol
|
|
| 10. | 详细信息 |
|
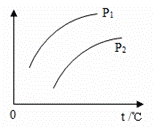
在一定容积的密闭容器中发生可逆反应A(g)+2B(g) A.P1<P2,纵坐标表示C的质量分数 B.P1<P2,纵坐标表示A的质量分数 C.P1>P2,纵坐标表示A的转化率 D.P1<P2,纵坐标表示混合气体的平均摩尔质量
|
|
| 11. | 详细信息 |
|
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是: A.A>B>C>D>E B.A>C>D>B>E C.C>A>B>D>E D.B>D>C>A>E
|
|
| 12. | 详细信息 |
|
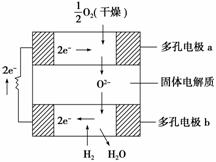
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是:
A.有O2放电的a极为电池的负极 B.有H2放电的b极为电池的正极 C.a极对应的电极反应式为O2+2H2O+4e-===4OH- D.该电池的总反应方程式为2H2+O2===2H2O
|
|
| 13. | 详细信息 |
|
在一密闭容器中,进行以下可逆反应O(g) +P(g) A.正反应放热,T是固体 B.正反应放热,T是气体 C.正反应吸热,T是气体 D.正反应放热,T是固体或气体
|
|
| 14. | 详细信息 |
|
在密闭容器中发生下列反应aA(g) A.A的转化率变小 B.平衡向逆反应方向移动 C.a>c+d D.D的体积分数变小
|
|
| 15. | 详细信息 |
|
关于下列装置的说法中正确的是:
A.装置①中,盐桥可用导电的金属丝替代 B.装置②通电过程中有Fe(OH)2产生 C.装置③用于电解法精炼铜中,d极溶解铜和c极析出铜的质量相等 D.装置④中有Cl2生成
|
|
| 16. | 详细信息 |
|
已知有如下热化学方程式 ① 2C(s)+O2(g)=2CO(g) ΔH1 ② 2H2(g)+O2(g)=2H2O(g) ΔH2 ③ C(s)+ H2O(g)=CO(g) +H2(g) ΔH3 则下列关系正确的是: A.ΔH3= C.ΔH3= |
|
| 17. | 详细信息 |
|
在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达到平衡的是: A.混合气体的压强 B.混合气体的密度 C.气体的平均摩尔质量 D.反应物A的质量
|
|
| 18. | 详细信息 |
|
一定条件下,将3molA和1molB两种气体混合于固定容积为2L密闭容器中,发生如下反应:3A(g)+B(g) A.从开始到平衡A的平均反应速率为0.225mol/(L∙s) C.此反应的化学平衡常数表达式K= D.若混合气体的密度不再改变时,该反应一定达到平衡状态
|
|
| 19. | 详细信息 |
|
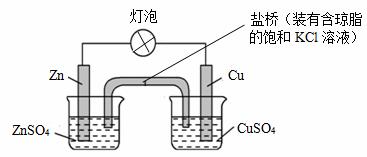
铜锌原电池(如图)工作时,下列叙述正确的是: A.正极反应为:Zn-2e-=Zn2+ B.盐桥中的K+移向ZnSO4溶液 C.电池反应为:Zn+Cu2+=Zn2++Cu D.在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极
|
|
| 20. | 详细信息 |
|
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是: A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C.电镀工业中,X是待镀金属,Y是镀层金属 D.外加电流的阴极保护法中,X是待保护金属
|
|
| 21. | 详细信息 |
|
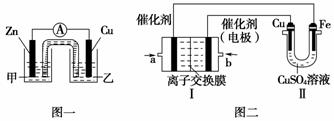
CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。
(2) 图一是根据反应Zn+CuSO4===Cu+ZnSO4设计成的锌铜原电池 ①该原电池的正极为 ,其外电路中的电子是从 极(填“Zn”或“Cu”)流出 ②电解质溶液乙是 (填“ZnSO4”或“CuSO4”)溶液, Zn极的电极反应式是 ③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是 (2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图 ①该同学想在Ⅱ中实现铁上镀铜,电解前CuSO4溶液的浓度为1mol/L,当线路中有0.1 mol电子通过时,则此时电解液CuSO4溶液的浓度为 ,阴极增重 g ②b处通入的是 (填“CH4”或“O2”), a处电极上发生的电极反应式是
|
|