2019йҷ•иҘҝй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜ—еҸҘжҲ–и°ҡиҜӯеҸҜиғҪдёҺеҢ–еӯҰзҺ°иұЎжңүе…іпјҢе…¶дёӯиҜҙжі•дёҚ A.вҖңж°ҙд№ідәӨиһҚпјҢзҒ«дёҠжөҮжІ№вҖқеүҚиҖ…еҢ…еҗ«зү©зҗҶеҸҳеҢ–пјҢиҖҢеҗҺиҖ…еҢ…еҗ«еҢ–еӯҰеҸҳеҢ– B.вҖңиҗҪжұӨиһғиҹ№зқҖзәўиўҚвҖқиӮҜе®ҡеҸ‘з”ҹдәҶеҢ–еӯҰеҸҳеҢ– C.вҖңж»ҙж°ҙзҹіз©ҝпјҢз»ій”ҜжңЁж–ӯвҖқдёҚеҢ…еҗ«еҢ–еӯҰеҸҳеҢ– D.вҖңзңӢдјјйЈҺе№іжөӘйқҷпјҢе®һеҲҷжҡ—жөҒж¶ҢеҠЁвҖқеҪўиұЎең°жҸҸиҝ°дәҶжә¶и§Је№іиЎЎзҡ„зҠ¶жҖҒ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз»ҷе®ҡжқЎд»¶дёӢпјҢдёӢеҲ—йҖүйЎ№дёӯжүҖзӨәзҡ„зү©иҙЁй—ҙиҪ¬еҢ–еқҮиғҪдёҖжӯҘе®һзҺ°зҡ„жҳҜ(гҖҖгҖҖ) AпјҺзІ—зЎ… BпјҺMg(OH)2 CпјҺFe2O3 DпјҺS
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
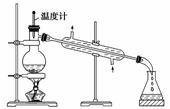
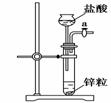
иҚүй…ёжҷ¶дҪ“(H2C2O4В·2H2O)100 в„ғејҖе§ӢеӨұж°ҙпјҢ101.5 в„ғзҶ”еҢ–пјҢ150 в„ғе·ҰеҸіеҲҶи§Јдә§з”ҹH2OгҖҒCOе’ҢCO2гҖӮз”ЁеҠ зғӯиҚүй…ёжҷ¶дҪ“зҡ„ж–№жі•иҺ·еҸ–жҹҗдәӣж°”дҪ“пјҢеә”иҜҘйҖүжӢ©зҡ„ж°”дҪ“еҸ‘з”ҹиЈ…зҪ®жҳҜ(еӣҫдёӯеҠ зғӯиЈ…зҪ®е·Із•ҘеҺ»)(гҖҖгҖҖ)гҖӮ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
NAдёәйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„еҖј,дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺ18gD2Oе’Ң18gH2Oдёӯеҗ«жңүзҡ„иҙЁеӯҗж•°еқҮдёә10NA BпјҺ2L0.5mol/LдәҡзЎ«й…ёжә¶ж¶Ідёӯеҗ«жңүзҡ„H+дёӨз§Қж•°дёә2NA CпјҺиҝҮж°§еҢ–й’ дёҺж°ҙеҸҚеә”ж—¶пјҢз”ҹжҲҗ0.1molж°§ж°”иҪ¬з§»зҡ„з”өеӯҗж•°дёә0.2NA DпјҺеҜҶй—ӯе®№еҷЁдёӯ2molNOдёҺ1molO2е……еҲҶеҸҚеә”пјҢдә§зү©зҡ„еҲҶ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫжҳҜеҚ°еңЁйЈҹе“ҒеҢ…иЈ…еҶ…еёёи§Ғе°ҸиўӢеӯҗдёҠзҡ„йғЁеҲҶеӣҫжЎҲпјҢиҜҘе°ҸиўӢеӯҗеҶ…зҡ„зү©иҙЁжңҖжңүеҸҜиғҪжҳҜ(гҖҖгҖҖ)
A.й“ҒзІүВ В В В В В В В В В B.ж°§еҢ–й’ В В В В В В В В C.дәҡзЎ«й…ёй’ В В В В В В В В В В В D.з”ҹзҹізҒ°
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—и§ЈйҮҠдәӢе®һзҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.й“Ғе’ҢзЁҖзЎқй…ёеҸҚеә”еҲ¶еҫ—жө…з»ҝиүІжә¶ж¶ІпјҡFeпјӢ4HпјӢпјӢNO B.е®һйӘҢе®Өзӣӣзўұж¶Ізҡ„瓶еӯҗдёҚз”ЁзҺ»з’ғеЎһпјҡSiO2пјӢ2OHпјҚ===SiO C.зўій…ёж°ўй•Ғе’Ңи¶ійҮҸзҡ„ж°ўж°§еҢ–й’ҷжә¶ж¶ІеҸҚеә”пјҡCa2пјӢпјӢOHпјҚпјӢHCO D.еҗ‘Ca(ClO)2жә¶ж¶ІдёӯйҖҡе…ҘиҝҮйҮҸCO2пјҡ2ClOпјҚпјӢH2OпјӢCO2==
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢXеҺҹеӯҗзҡ„жңҖеӨ–еұӮжңү6дёӘз”өеӯҗпјҢYжҳҜиҝ„д»ҠеҸ‘зҺ°зҡ„йқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ пјҢеңЁе‘ЁжңҹиЎЁдёӯZдҪҚдәҺIAж—ҸпјҢWдёҺXеұһдәҺеҗҢдёҖдё»ж—ҸгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺе…ғзҙ XгҖҒWзҡ„з®ҖеҚ•йҳҙзҰ»еӯҗе…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„ BпјҺз”ұYгҖҒZдёӨз§Қе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©жҳҜзҰ»еӯҗеҢ–еҗҲзү© CпјҺWзҡ„з®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§жҜ”Yзҡ„ејә DпјҺеҺҹеӯҗеҚҠеҫ„пјҡrпјҲXпјүпјңrпјҲYпјүпјңrпјҲ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
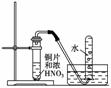
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҗ‘иЈ…жңүFe(NO3)2жә¶ж¶Ізҡ„иҜ•з®ЎдёӯеҠ е…ҘзЁҖH2SO4пјҢеңЁз®ЎеҸЈи§ӮеҜҹеҲ°зәўжЈ•иүІж°”дҪ“пјҢз»“и®әпјҡHNO3еҲҶи§ЈжҲҗдәҶNO2 BпјҺе®һйӘҢе®ӨжЈҖйӘҢж°Ёж°”зҡ„ж–№жі•жҳҜе°Ҷж№ҝж¶Ұзҡ„и“қиүІзҹіи•ҠиҜ•зәёйқ иҝ‘瓶еҸЈжҲ–з®ЎеҸЈпјҢи§ӮеҜҹиҜ•зәёжҳҜеҗҰе‘ҲзәўиүІ CпјҺзҒј DпјҺжө“зЎқй…ёжңүејәж°§еҢ–жҖ§пјҢеёёжё©дёӢиғҪдёҺFeеҸ‘з”ҹеү§зғҲеҸҚеә”
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
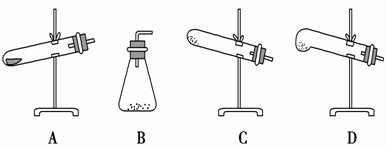
дёӢеҲ—йҖүз”Ёзҡ„е®һйӘҢд»ӘеҷЁжҲ–е®һйӘҢиЈ…зҪ®з¬ҰеҗҲе®һйӘҢиҰҒжұӮдё”е®үе…Ёзҡ„жҳҜ(гҖҖгҖҖ)гҖӮ
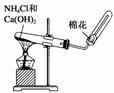
AпјҺе®һйӘҢе®ӨеҲ¶еӨҮе°‘йҮҸи’ёйҰҸж°ҙгҖҖгҖҖгҖҖBпјҺе®һйӘҢе®ӨеҲ¶еӨҮж°Ёж°”
CпјҺе®һйӘҢе®ӨеҲ¶еӨҮNO2В В В В В В В В В DпјҺе®һйӘҢе®ӨеҲ¶еӨҮж°ўж°”
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
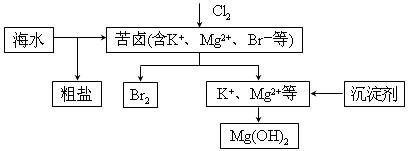
жө·ж°ҙејҖеҸ‘еҲ©з”Ёзҡ„йғЁеҲҶиҝҮзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲВ В пјү
AпјҺеҗ‘иӢҰеҚӨдёӯйҖҡе…ҘCl2жҳҜдёәдәҶжҸҗеҸ–жәҙ BпјҺзІ—зӣҗеҸҜйҮҮз”ЁйҷӨжқӮе’ҢйҮҚз»“жҷ¶зӯүиҝҮзЁӢжҸҗзәҜ CпјҺе·Ҙдёҡз”ҹдә§дёӯеёёйҖүз”ЁNaOHдҪңдёәжІүж·ҖеүӮ DпјҺеҜҢйӣҶжәҙдёҖиҲ¬е…Ҳз”Ёз©әж°”е’Ңж°ҙи’ёж°”еҗ№еҮәеҚ•иҙЁжәҙпјҢеҶҚз”ЁSO2е°Ҷе…¶иҝҳеҺҹеҗёж”¶
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
|
дёӢеҲ—йҷӨжқӮж–№жЎҲй”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ)
|
||||||||||||||||||||||||||
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
O2F2еҸҜд»ҘеҸ‘з”ҹеҸҚеә”пјҡH2S+4O2F2вҶ’SF6+2HF+4O2пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺж°§ж°”жҳҜж°§еҢ–дә§зү© BпјҺO2F2ж—ўжҳҜж°§еҢ–еүӮеҸҲжҳҜиҝҳеҺҹеүӮ CпјҺиӢҘз”ҹжҲҗ4.48 L HFпјҢеҲҷиҪ¬з§»0.8 molз”өеӯҗ DпјҺиҝҳеҺҹеүӮ
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
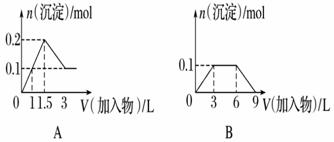
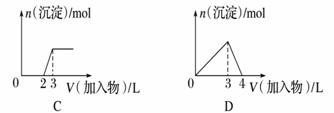
дёӢеҲ—жӣІзәҝеӣҫ(зәөеқҗж ҮдёәжІүж·Җзҡ„йҮҸпјҢжЁӘеқҗж ҮдёәеҠ е…Ҙзү©иҙЁзҡ„йҮҸ)дёҺеҜ№еә”зҡ„йҖүйЎ№зӣёз¬ҰеҗҲзҡ„жҳҜ(гҖҖгҖҖ)
A.еҗ‘1 Lжө“еәҰеқҮдёә0.1 molВ·LпјҚ1зҡ„Ba(OH)2гҖҒNaAlO2ж··еҗҲжә¶ж¶ІдёӯеҠ е…Ҙ0.1 molВ·LпјҚ1зҡ„зЁҖH2SO4 B.еҗ‘1 Lжө“еәҰеҲҶеҲ«дёә0.1 molВ·LпјҚ1е’Ң0.3 molВ·LпјҚ1зҡ„AlCl3гҖҒNH4Clзҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…Ҙ 0.1 molВ·LпјҚ1зҡ„зЁҖNaOHжә¶ж¶І C.еҗ‘зғ§зўұжә¶ж¶Ідёӯж»ҙеҠ жҳҺзҹҫжә¶ж¶І D.еҗ‘AlCl3жә¶ж¶Ідёӯж»ҙеҠ иҝҮйҮҸж°Ёж°ҙ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗй“Ғзҡ„ж°§еҢ–зү©пјҲFexOпјү1.52gжә¶дәҺи¶ійҮҸзӣҗй…ёдёӯпјҢеҗ‘жүҖеҫ—жә¶ж¶ІдёӯйҖҡе…Ҙж ҮеҮҶзҠ¶еҶөдёӢ112mlCl2пјҢжҒ°еҘҪе°ҶFe2+е®Ңе…Ёж°§еҢ–гҖӮxеҖјдёәпјҲВ В пјү AпјҺ0.80В В В В В В В В В BпјҺ0.85В В В В В В В В В В В CпјҺ0.90В В В В В В В В В DпјҺ0.93
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
.дёӢеҲ—жңүе…ій“Ғе…ғзҙ зҡ„еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.Fe(OH)2жҳ“иў«ж°§еҢ–жҲҗFe(OH)3пјҢиҜҙжҳҺзЁіе®ҡжҖ§пјҡFe(OH)2<Fe(OH)3 B.й“ҒжҳҜиҫғжҙ»жіјзҡ„йҮ‘еұһпјҢе®ғдёҺеҚӨзҙ (X2)еҸҚеә”зҡ„з”ҹжҲҗзү©еқҮдёәFeX3 C.ж°ўж°§еҢ–й“ҒдёҺж°ўзўҳй…ёеҸҚеә”пјҡFe(OH)3пјӢ3HI===FeI3пјӢ3H2O D.е°ҶFeCl3йҘұе’Ңжә¶ж¶Іж»ҙе…ҘNaOHжә¶ж¶ІдёӯеҸҜеҲ¶еӨҮFe(OH)3иғ¶дҪ“
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺIзҡ„еҺҹеӯҗеҚҠеҫ„еӨ§дәҺBrпјҢHIжҜ”HBrзҡ„зғӯзЁіе®ҡжҖ§ејә BпјҺPзҡ„йқһйҮ‘еұһжҖ§ејәдәҺSiпјҢH3PO4жҜ”H2SiO3зҡ„й…ёжҖ§ејә CпјҺAl2O3е’ҢMgOеқҮеҸҜдёҺNaOHжә¶ж¶ІеҸҚеә” DпјҺSO2е’ҢSO3ж··еҗҲж°”дҪ“йҖҡе…ҘBa(NO3)2жә¶ж¶ІеҸҜеҫ—еҲ°BaSO3е’ҢBaSO4
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёүж°ҹеҢ–ж°®(NF3)жҳҜдёҖз§Қж— иүІгҖҒж— е‘ізҡ„ж°”дҪ“пјҢе®ғжҳҜеҫ®з”өеӯҗе·ҘдёҡжҠҖжңҜзҡ„е…ій”®еҺҹж–ҷд№ӢдёҖпјҢдёүж°ҹеҢ–ж°®еңЁжҪ®ж№ҝзҡ„з©әж°”дёӯдёҺж°ҙи’ёж°”иғҪеҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢе…¶еҸҚеә”зҡ„дә§зү©жңүHFгҖҒNOе’ҢHNO3пјҢиҜ·ж №жҚ®иҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҸҚеә”иҝҮзЁӢдёӯпјҢиў«ж°§еҢ–дёҺиў«иҝҳеҺҹзҡ„е…ғзҙ еҺҹеӯҗзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә________гҖӮ (2)еҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ____________________________________гҖӮ иӢҘеҸҚеә”дёӯз”ҹжҲҗ0.2 mol HNO3пјҢиҪ¬з§»зҡ„з”өеӯҗж•°зӣ®дёә________дёӘгҖӮ (3)дёүж°ҹеҢ–ж°®еҸҜз”ұж°Ёж°”е’Ңж°ҹж°”еҸҚеә”еҫ—еҲ°пјҡ4NH3пјӢ3F2===NF3пјӢ3NH4FгҖӮжҚ®йўҳж„ҸжҺЁжөӢNF3гҖҒF2гҖҒNOдёүз§Қж°”дҪ“дёӯпјҢж°§еҢ–жҖ§з”ұејұеҲ°ејәзҡ„йЎәеәҸдёә______________гҖӮ (4)NF3жҳҜдёҖз§Қж— иүІгҖҒж— е‘і (
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
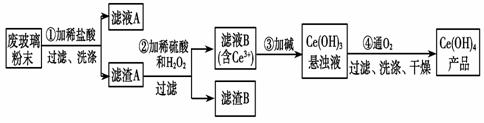
е№іжқҝз”өи§ҶжҳҫзӨәеұҸз”ҹдә§иҝҮзЁӢдёӯдә§з”ҹеӨ§йҮҸзҡ„еәҹзҺ»з’ғзІүжң«пјҢе…¶дёӯеҗ«жңүSiO2гҖҒFe2O3гҖҒCeO2д»ҘеҸҠе…¶д»–е°‘йҮҸеҸҜжә¶дәҺзЁҖй…ёзҡ„зү©иҙЁгҖӮдәҢж°§еҢ–
(1)第①жӯҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ___________________________________________________пјҢ жЈҖйӘҢж»ӨжёЈAжҳҜеҗҰжҙ—еҮҖзҡ„ж–№жі•жҳҜ____________________________________________________гҖӮ (2)第②жӯҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ________________________________________ (3)иҗғеҸ–жҳҜеҲҶзҰ»зЁҖеңҹе…ғзҙ зҡ„еёёз”Ёж–№жі•пјҢеҢ–еҗҲзү©TBPдҪңдёәиҗғеҸ–еүӮиғҪе°Ҷй“ҲзҰ»еӯҗд»Һж°ҙжә¶ж¶І (4)еҸ–дёҠиҝ°жөҒзЁӢдёӯеҫ—еҲ°зҡ„Ce(OH)4дә§е“Ғ0.5 gпјҢеҠ зЎ«й…ёжә¶и§ЈеҗҺпјҢз”Ё0.100 0 molВ·LпјҚ1 FeSO4ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡз»ҲзӮ№ж—¶(й“Ҳиў«иҝҳеҺҹдёәCe3пјӢ)пјҢж¶ҲиҖ—20.00 mLж ҮеҮҶжә¶ж¶ІпјҢиҜҘдә§е“ҒдёӯCe(OH)4зҡ„иҙЁйҮҸеҲҶж•°дёә________(дҝқз•ҷе°Ҹж•°зӮ№еҗҺдёҖдҪҚ)гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
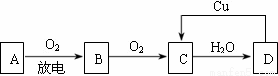
AгҖҒBгҖҒCгҖҒDеӣӣз§Қзү©иҙЁд№Ӣй—ҙжңүдёӢеӣҫжүҖзӨәзҡ„иҪ¬еҢ–е…ізі»гҖӮе·ІзҹҘпјҡAжҳҜз©әж°”дёӯзҡ„дё»иҰҒжҲҗеҲҶпјҢBгҖҒCгҖҒD
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҶҷеҮәAе’ҢCзҡ„еҗҚз§°жҲ–еҢ–еӯҰејҸпјҡAВ В В В В В В В В В В В В В (2)еңЁдёҠеӣҫDвҶ’Cзҡ„иҝҮзЁӢдёӯпјҢDиЎЁзҺ°еҮәејәВ В В В В В В В В пјҲеЎ«вҖңж°§еҢ–жҖ§вҖқжҲ–вҖңиҝҳеҺҹжҖ§вҖқпјүпјӣ (3)еңЁDзҡ„зЁҖжә¶ж¶Ідёӯж»ҙе…ҘNaOHжә¶ж¶ІпјҢе…¶еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
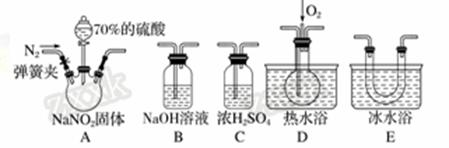
дәҡзЎқй…ёй’ (NaNO2)еңЁзәӨз»ҙзәәз»Үе“Ғзҡ„жҹ“иүІе’ҢжјӮзҷҪгҖҒз…§зӣёгҖҒз”ҹдә§ж©Ўиғ¶гҖҒеҲ¶иҚҜзӯүйўҶеҹҹжңүе№ҝжіӣеә”з”ЁпјҢд№ҹеёёз”ЁдәҺйұјзұ»гҖҒиӮүзұ»зӯүйЈҹе“Ғзҡ„жҹ“иүІе’ҢйҳІи…җгҖӮдҪҶеӣ е…¶жңүжҜ’пјҢжүҖд»ҘеңЁйЈҹе“ҒиЎҢдёҡз”ЁйҮҸжңүдёҘж јйҷҗеҲ¶гҖӮзҺ°з”ЁдёӢеӣҫжүҖзӨәд»ӘеҷЁ(еӨ№жҢҒиЈ…зҪ®е·ІзңҒз•Ҙ)еҸҠиҚҜе“ҒпјҢжҺўз©¶дәҡзЎқй…ёй’ дёҺзЎ«й…ёеҸҚеә”еҸҠж°”дҪ“дә§зү©зҡ„жҲҗеҲҶгҖӮ е·ІзҹҘпјҡв‘ NOпјӢNO2пјӢ2OHпјҚ===2NO в‘Ўж°”дҪ“ж¶ІеҢ–зҡ„жё©еәҰпјҡNO2дёә21 в„ғпјҢNOдёәпјҚ152 в„ғ (1)дёәдәҶжЈҖйӘҢиЈ…зҪ®Aдёӯз”ҹжҲҗзҡ„ж°”дҪ“дә§зү©пјҢд»ӘеҷЁзҡ„иҝһжҺҘйЎәеәҸ(жҢүе·ҰвҶ’еҸіиҝһжҺҘ)дёәAгҖҒCгҖҒ________гҖҒ______гҖҒ______гҖӮ (2)еҸҚеә”еүҚеә”жү“ејҖеј№з°§еӨ№пјҢе…ҲйҖҡе…ҘдёҖж®өж—¶й—ҙж°®ж°”пјҢжҺ’йҷӨиЈ…зҪ®дёӯзҡ„з©әж°”пјҢзӣ®зҡ„жҳҜ________________ гҖӮ (3)еңЁе…ій—ӯеј№з°§еӨ№гҖҒжү“ејҖеҲҶж¶ІжјҸж–—жҙ»еЎһгҖҒж»ҙе…Ҙ70%зЎ«й…ёеҗҺпјҢAдёӯдә§з”ҹзәўжЈ•иүІж°”дҪ“гҖӮ в‘ зЎ®и®ӨAдёӯдә§з”ҹзҡ„ж°”дҪ“еҗ«жңүNOпјҢдҫқжҚ®зҡ„зҺ°иұЎжҳҜ_____________________________________ в‘ЎиЈ…зҪ®Eзҡ„дҪңз”ЁжҳҜ__________________________________________________________В В В В В гҖӮ (4)еҰӮжһңеҗ‘DдёӯйҖҡе…ҘиҝҮйҮҸO2пјҢеҲҷиЈ…зҪ®BдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_______________________гҖӮ еҰӮжһңжІЎжңүиЈ…зҪ®CпјҢеҜ№е®һйӘҢз»“и®әйҖ жҲҗзҡ„еҪұе“ҚжҳҜ__________________________________________гҖӮ (5)йҖҡиҝҮдёҠиҝ°е®һйӘҢжҺўз©¶иҝҮзЁӢпјҢеҸҜеҫ—еҮәиЈ…зҪ®AдёӯеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ________________________гҖӮ
|
|
- 2019еұҠй«ҳдёүдёҠеӯҰжңҹ12жңҲжңҲиҖғзҗҶ科综еҗҲеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲеұұдёңзңҒжһЈеә„еёӮ第дёүдёӯеӯҰж–°еҹҺж ЎеҢәпјү
- 2020еұҠдәәж•ҷзүҲй«ҳдёүеҢ–еӯҰдәҢиҪ®еӨҚд№ йҖүжӢ©йўҳдё“ж”»з»ғ--жңүжңәеҢ–еӯҰзү©иҙЁз»“жһ„жҖ§иҙЁ
- 2020е№ҙ10жңҲжұҹиӢҸиӢҸе·һеёӮеӣӯеҢәиҘҝдәӨеӨ§иӢҸе·һйҷ„еұһдёӯеӯҰй«ҳдёҖдёҠжңҹжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- жұҹиҘҝ2019е№ҙй«ҳдәҢеүҚеҚҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№
- иҘҝи—Ҹ2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠе№ҙжңҹжң«иҖғиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ
- еӨ©жҙҘеёӮж»Ёжө·ж–°еҢәеӨ§жёҜ油田第дёүдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- й«ҳдёҖдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲ2019-2020е№ҙжІіеҢ—зңҒиЎЎж°ҙеёӮйҳңеҹҺдёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰпјҲдә‘еҚ—зңҒзҺүжәӘ第дёҖдёӯеӯҰпјү