дәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰеҗҢжӯҘз»ғд№
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
е®№йҮҸ瓶жҳҜз”ЁжқҘй…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰжә¶ж¶Ізҡ„е®ҡйҮҸд»ӘеҷЁпјҢе…¶дёҠж Үжңүпјҡв‘ жё©еәҰгҖҖв‘Ўжө“еәҰгҖҖв‘ўе®№з§ҜгҖҖв‘ЈеҺӢејәгҖҖв‘ӨеҲ»еәҰзәҝгҖҖв‘Ҙй…ёејҸжҲ–зўұејҸпјҢиҝҷе…ӯйЎ№дёӯзҡ„(гҖҖгҖҖ) AпјҺв‘Ўв‘Јв‘ҘгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В BпјҺв‘ўв‘Өв‘Ҙ CпјҺв‘ в‘Ўв‘Ј В В В В В В В В В В В В В В В В В В В В В В В DпјҺв‘ в‘ўв‘Ө
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
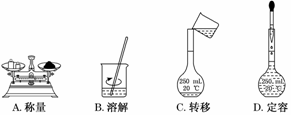
з”ЁеӣәдҪ“ж ·е“Ғй…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жә¶ж¶ІпјҢйңҖз»ҸиҝҮз§°йҮҸгҖҒжә¶и§ЈгҖҒиҪ¬з§»жә¶ж¶ІгҖҒе®ҡе®№зӯүж“ҚдҪңгҖӮдёӢеҲ—еӣҫзӨәеҜ№еә”зҡ„ж“ҚдҪң规иҢғзҡ„жҳҜ(гҖҖгҖҖ)
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
й…ҚеҲ¶100 mL 1.0 molВ·LпјҚ1 NaOHжә¶ж¶ІгҖӮдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ) AпјҺй…ҚеҲ¶ж—¶пјҢеә”йҖүз”Ё100 mLзҡ„е®№йҮҸ瓶 BпјҺеңЁжүҳзӣҳеӨ©е№ідёҠж”ҫдёӨзүҮи§„ж јзӣёеҗҢзҡ„ж»ӨзәёпјҢе°ҶNaOHж”ҫеңЁж»ӨзәёдёҠз§°йҮҸ CпјҺз”Ёи’ёйҰҸж°ҙжҙ—ж¶Өзғ§жқҜе’ҢзҺ»з’ғжЈ’2пҪһ3ж¬ЎпјҢе°Ҷжҙ—ж¶Өж¶ІдёҖ并иҪ¬з§»еҲ°е®№йҮҸ瓶дёӯ DпјҺжҠҠз§°еҸ–зҡ„NaOHз”ЁйҖӮйҮҸи’ёйҰҸж°ҙжә¶и§ЈгҖҒеҶ·еҚҙпјҢиҪ¬з§»иҮіе®№йҮҸ瓶дёӯ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®ӨдёӯйңҖиҰҒй…ҚеҲ¶0.2 molВ·LпјҚ1зҡ„CuSO4жә¶ж¶І950 mLпјҢй…ҚеҲ¶ж—¶еә”йҖүз”Ёзҡ„е®№йҮҸ瓶зҡ„и§„ж је’Ңз§°еҸ–зҡ„CuSO4 зҡ„иҙЁйҮҸеҲҶеҲ«жҳҜ(гҖҖгҖҖ) AпјҺ950 mLгҖҖ30.4 g В В В В В В В В В В В В В В В BпјҺ500 mLгҖҖ16 g CпјҺ1 000 mLгҖҖ32 g В В В В В В В В В В В В В В В DпјҺд»»ж„Ҹи§„ж јгҖҖ30.4 g
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іе®№йҮҸ瓶зҡ„дҪҝз”ЁеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺе®№йҮҸ瓶дёҚиғҪз”ЁдҪңй•ҝжңҹиҙ®еӯҳиҜ•еүӮзҡ„е®№еҷЁпјҢдҪҶжҳҜеҪ“жә¶ж¶Ій…ҚеҲ¶е®ҢеҗҺпјҢеҸҜд»Ҙз”ЁжқҘеӯҳж”ҫй…ҚеҲ¶зҡ„иҜ•еүӮ BпјҺз”Ё500 mLзҡ„е®№йҮҸ瓶еҸҜд»ҘзӣҙжҺҘй…ҚеҲ¶480 mLжә¶ж¶І CпјҺе®№йҮҸ瓶дёҚеҸҜд»Ҙз”ЁжқҘжә¶и§ЈеӣәдҪ“пјҢдҪҶжҳҜеҸҜд»Ҙз”ЁжқҘзЁҖйҮҠжө“зҡ„жә¶ж¶І DпјҺе®№йҮҸ瓶дёҚеҸҜд»Ҙз”ЁжқҘеҠ зғӯпјҢдҪҶжҳҜй”ҘеҪўз“¶еҸҜд»Ҙз”ЁжқҘеҠ зғӯ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸ–100 mL 0.3 molВ·LпјҚ1 H2SO4жә¶ж¶Іе’Ң300 mL 0.25 molВ·LпјҚ1 H2SO4жә¶ж¶ІдёҖиө·жіЁе…Ҙ500 mLзҡ„е®№йҮҸ瓶дёӯпјҢеҠ ж°ҙзЁҖйҮҠиҮіеҲ»еәҰзәҝпјҢеҲҷжүҖеҫ—жә¶ж¶ІдёӯHпјӢзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә(гҖҖгҖҖ) AпјҺ0.21 molВ·LпјҚ1 В В В В В В В В В В В В В В В В BпјҺ0.56 molВ·LпјҚ1 CпјҺ0.42 molВ·LпјҚ1 В В В В В В В В В В В В В В В В DпјҺ0.26 molВ·LпјҚ1
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
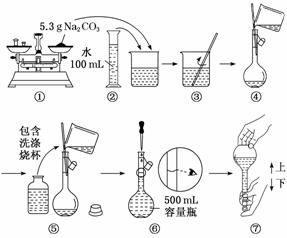
жҹҗеҗҢеӯҰз”ЁNa2CO3й…ҚеҲ¶0.10 molВ·LпјҚ1 Na2CO3жә¶ж¶Ізҡ„иҝҮзЁӢеҰӮеӣҫжүҖзӨәгҖӮдҪ и®ӨдёәиҜҘеҗҢеӯҰзҡ„й”ҷиҜҜжңү(гҖҖгҖҖ)
AпјҺв‘ в‘Ө В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺв‘Ўв‘Ј CпјҺв‘ в‘Ҙ В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺв‘Өв‘Ҙ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
й…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„жҹҗжә¶ж¶ІпјҢдёӢеҲ—жғ…еҶөдјҡдҪҝй…ҚеҲ¶з»“жһңеҒҸдҪҺзҡ„жҳҜ(гҖҖгҖҖ) AпјҺжңӘеҶ·еҚҙеҚіиҪ¬з§»гҖҒе®ҡе®№ BпјҺжңӘжҙ—зғ§жқҜеҸҠзҺ»з’ғжЈ’ CпјҺе®ҡе®№ж—¶дҝҜи§ҶеҲ»еәҰзәҝи§ӮеҜҹж¶Ійқў DпјҺе®№йҮҸ瓶дёӯеҺҹжңүе°‘йҮҸи’ёйҰҸж°ҙ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺе®№йҮҸ瓶дҪҝз”Ёзҡ„еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺдёәдәҶдҪҝжүҖй…Қжә¶ж¶Іжө“еәҰеқҮеҢҖпјҢе®ҡе®№з»“жқҹеҗҺпјҢжүӢжҸЎз“¶йўҲе·ҰеҸіжҢҜиҚЎ BпјҺз”Ёи’ёйҰҸж°ҙжҙ—еҗҺеҝ…йЎ»иҰҒе°Ҷе®№йҮҸ瓶зғҳе№І CпјҺдёәдәҶж“ҚдҪңз®ҖдҫҝпјҢжө“жә¶ж¶ІзЁҖйҮҠеҸҜзӣҙжҺҘеңЁе®№йҮҸ瓶дёӯиҝӣиЎҢ DпјҺдҪҝз”ЁеүҚиҰҒжЈҖжҹҘе®№йҮҸ瓶жҳҜеҗҰжјҸж¶І
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
25 в„ғж—¶пјҢе°Ҷ10 mLиҙЁйҮҸеҲҶж•°дёә50%(еҜҶеәҰдёә1.4 gВ·cmпјҚ3)зҡ„зЎ«й…ёзЁҖйҮҠжҲҗ100 mLгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺдҝҜи§Ҷе®№йҮҸ瓶еҲ»еәҰзәҝе®ҡе®№пјҢжүҖй…Қжә¶ж¶Ізҡ„жө“еәҰеҒҸе°Ҹ BпјҺзЁҖйҮҠиҝҮзЁӢжүҖйңҖиҰҒзҡ„и’ёйҰҸж°ҙдёә90 mL CпјҺиҙЁйҮҸеҲҶж•°дёә50%зҡ„зЎ«й…ёжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзәҰдёә7.14 molВ·LпјҚ1 DпјҺзЁҖйҮҠеҗҺзҡ„100 mLзЁҖзЎ«й…ёдёӯеҗ«жә¶иҙЁ14 gпјҢиҜҘзЁҖзЎ«й…ёдёҚеұһдәҺз”өи§ЈиҙЁ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңүдёҖ瓶1 000 mLгҖҒеҗ«25% NaClOгҖҒеҜҶеәҰжҳҜ1.19 gВ·cmпјҚ3зҡ„вҖң84вҖқж¶ҲжҜ’ж¶ІпјҢдҪҝз”Ёж—¶йңҖиҰҒзЁҖйҮҠ100еҖҚ(дҪ“з§ҜжҜ”)пјҢеҜҶе°ҒдҝқеӯҳгҖӮдёӢеҲ—еҲҶжһҗдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺиҜҘвҖң84вҖқж¶ҲжҜ’ж¶ІдёӯNaClOзү©иҙЁзҡ„йҮҸжө“еәҰдёә4.0 molВ·LпјҚ1 BпјҺиҜҘвҖң84вҖқж¶ҲжҜ’ж¶ІзЁҖйҮҠ100еҖҚеҗҺпјҢNaпјӢзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә0.04 molВ·LпјҚ1 CпјҺз©әж°”дёӯзҡ„CO2дёҺвҖң84вҖқж¶ҲжҜ’ж¶ІеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜNaClOпјӢCO2пјӢH2O===NaHCO3пјӢHClO DпјҺз”Ёе®№йҮҸ瓶й…ҚеҲ¶дёҠиҝ°жө“еәҰзҡ„вҖң84вҖқж¶ҲжҜ’ж¶І480 mLпјҢйңҖиҰҒз§°йҮҸзҡ„NaClOеӣәдҪ“иҙЁйҮҸдёә143.0 g
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж°ҜеҢ–й•Ғжә¶ж¶Ізҡ„еҜҶеәҰдёә1.18 gВ·cmпјҚ3пјҢе…¶дёӯй•ҒзҰ»еӯҗзҡ„иҙЁйҮҸеҲҶж•°дёә5.1%,300 mLиҜҘжә¶ж¶ІдёӯClпјҚзҡ„зү©иҙЁзҡ„йҮҸзәҰдёә(гҖҖгҖҖ) AпјҺ0.37 molгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В BпјҺ0.63 mol CпјҺ0.74 mol В В В В В В В В В В В В В В В В В В В В В DпјҺ1.5 mol
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёӢеҲ—еҢ–еӯҰд»ӘеҷЁпјҡв‘ жүҳзӣҳеӨ©е№ігҖҖв‘ЎзҺ»з’ғжЈ’гҖҖв‘ўиҚҜеҢҷгҖҖв‘Јзғ§жқҜгҖҖв‘ӨйҮҸзӯ’гҖҖв‘Ҙе®№йҮҸ瓶гҖҖв‘Ұиғ¶еӨҙж»ҙз®ЎгҖҖ⑧з»ҶеҸЈиҜ•еүӮ瓶гҖҖв‘Ёж ҮзӯҫзәёгҖӮ (1)зҺ°йңҖиҰҒй…ҚеҲ¶500 mL 1 molВ·LпјҚ1 H2SO4жә¶ж¶ІпјҢйңҖиҰҒиҙЁйҮҸеҲҶж•°дёә98%гҖҒеҜҶеәҰдёә1.84 gВ·cmпјҚ3зҡ„жө“H2SO4________mLгҖӮ (2)дёҠиҝ°д»ӘеҷЁдёӯпјҢжҢүе®һйӘҢиҰҒжұӮдҪҝз”Ёзҡ„е…ҲеҗҺйЎәеәҸжҳҜ__________________(еЎ«ж ҮеҸ·)гҖӮ (3)иӢҘе®һйӘҢйҒҮеҲ°дёӢеҲ—жғ…еҶөпјҢеҜ№зЎ«й…ёжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжңүдҪ•еҪұе“Қ(еЎ«вҖңеҒҸй«ҳвҖқвҖңеҒҸдҪҺвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ в‘ з”Ёд»ҘзЁҖйҮҠжө“зЎ«й…ёзҡ„зғ§жқҜжңӘжҙ—ж¶ӨпјҢ__________гҖӮ в‘ЎжңӘз»ҸеҶ·еҚҙе°Ҷжә¶ж¶ІжіЁе…Ҙе®№йҮҸ瓶дёӯпјҢ__________гҖӮ в‘ўж‘ҮеҢҖеҗҺеҸ‘зҺ°ж¶ІйқўдёӢйҷҚеҶҚеҠ ж°ҙпјҢ__________гҖӮ в‘Је®ҡе®№ж—¶дҝҜи§Ҷи§ӮеҜҹж¶ІйқўпјҢ__________гҖӮ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
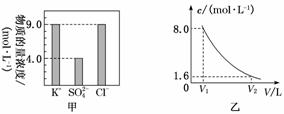
жҹҗ0.2 Lж— еңҹж Ҫеҹ№з”Ёзҡ„иҗҘе…»ж¶Ідёӯеҗ«жңүKClгҖҒK2SO4гҖҒNH4Clдёүз§Қжә¶иҙЁпјҢжөӢеҫ—иҜҘиҗҘе…»ж¶ІдёӯйғЁеҲҶзҰ»еӯҗзҡ„жө“еәҰжҹұзҠ¶еӣҫеҰӮеӣҫз”ІжүҖзӨәпјҡ
(1)иҜҘиҗҘе…»ж¶ІдёӯK2SO4зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә____________molВ·LпјҚ1пјҢеҗ«KClзҡ„иҙЁйҮҸдёә________гҖӮ (2)иҜҘиҗҘе…»ж¶ІдёӯNH4Clзҡ„зү©иҙЁзҡ„йҮҸдёә________гҖӮ (3)е°ҶиҜҘиҗҘе…»ж¶ІеҠ ж°ҙзЁҖйҮҠпјҢзЁҖйҮҠиҝҮзЁӢдёӯNH
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®Өй…ҚеҲ¶0.1 molВ·LпјҚ1зҡ„BaCl2жә¶ж¶ІеҸҜеҲҶдёӨдёӘйҳ¶ж®өиҝӣиЎҢгҖӮ 第дёҖйҳ¶ж®өпјҡз”ЁжүҳзӣҳеӨ©е№із§°еҸ–5.2 gж— ж°ҙBaCl2жҷ¶дҪ“гҖӮ 第дәҢйҳ¶ж®өпјҡжә¶и§Јй…ҚеҲ¶0.1 molВ·LпјҚ1зҡ„BaCl2жә¶ж¶ІгҖӮ 第дёҖйҳ¶ж®өж“ҚдҪңжңүеҰӮдёӢеҮ жӯҘпјҡA.е°Ҷжёёз ҒжӢЁиҮі0.2 gеӨ„пјӣB.е°Ҷжёёз ҒжӢЁиҮівҖң0вҖқеӨ„пјӣC.еңЁеӨ©е№ідёӨиҫ№зҡ„жүҳзӣҳдёҠеҗ„ж”ҫдёҖеј е№ІеҮҖзҡ„зӯүиҙЁйҮҸзҡ„ж»ӨзәёпјҢи°ғиҠӮеӨ©е№ідёӨиҫ№зҡ„иһәжҜҚдҪҝеӨ©е№іе№іиЎЎпјӣD.еҸ–иө°иҚҜе“ҒпјҢе°Ҷз қз Ғж”ҫеӣһз қз Ғзӣ’еҶ…пјӣE.еҫҖе·ҰзӣҳеҶ…йҖҗжӯҘж·»еҠ жҷ¶дҪ“иҮіеӨ©е№іе№іиЎЎпјӣF.еңЁеҸізӣҳдёҠж”ҫзҪ®5 gз қз ҒгҖӮ (1)е…¶жӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸжҳҜ(еЎ«ж ҮеҸ·)пјҡ BвҶ’(гҖҖгҖҖ)вҶ’(гҖҖгҖҖ)вҶ’AвҶ’(гҖҖгҖҖ)вҶ’(гҖҖгҖҖ)вҶ’(гҖҖгҖҖ)гҖӮ (2)еңЁEж“ҚдҪңдёӯпјҢеҸӘзјәе°‘йҮҸжҷ¶дҪ“ж—¶пјҢе…¶ж“ҚдҪңж–№жі•жҳҜ_______________________________ ________________________________________________________________________гҖӮ (3)第дәҢйҳ¶ж®өж“ҚдҪңпјҢеә”е…Ҳе°Ҷ5.2 g BaCl2еҠ йҖӮйҮҸи’ёйҰҸж°ҙжә¶и§ЈпјҢжә¶и§ЈиҝҮзЁӢдёӯдҪҝз”Ёзҡ„дё»иҰҒд»ӘеҷЁжңү________гҖҒ________гҖӮ然еҗҺе°Ҷжә¶ж¶ІиҪ¬е…Ҙ________дёӯпјҢеҶҚз»Ҹ________гҖҒ________гҖҒ_______еҗҺеҚіеҸҜеҫ—еҲ°0.1 molВ·LпјҚ1 BaCl2жә¶ж¶ІгҖӮ (4)дёӢеҲ—ж“ҚдҪңдҪҝй…ҚеҲ¶зҡ„BaCl2жә¶ж¶Іжө“еәҰеҒҸдҪҺзҡ„жңү________(еЎ«еӯ—жҜҚеәҸеҸ·)гҖӮ AпјҺе°Ҷз қз Ғж”ҫеңЁе·ҰзӣҳдёҠпјҢBaCl2ж”ҫеңЁеҸізӣҳдёҠиҝӣиЎҢз§°йҮҸ BпјҺйҖүз”Ёзҡ„е®№йҮҸ瓶еҶ…жңүе°‘йҮҸи’ёйҰҸж°ҙ CпјҺе®ҡе®№ж‘ҮеҢҖеҗҺпјҢж¶ІйқўдёӢйҷҚпјҢеҸҲеҠ ж°ҙиҮіеҲ»еәҰзәҝ DпјҺж•ҙдёӘй…ҚеҲ¶иҝҮзЁӢдёӯпјҢе®№йҮҸ瓶дёҚжҢҜиҚЎ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®ӨиҰҒй…ҚеҲ¶500 mL 0.2 molВ·LпјҚ1 NaOHжә¶ж¶ІпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)й…ҚеҲ¶иҝҮзЁӢдёӯдёҚйңҖиҰҒдҪҝз”Ёзҡ„еҢ–еӯҰд»ӘеҷЁжңү__________(еЎ«ж ҮеҸ·)гҖӮ AпјҺзғ§жқҜгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В В В В В В В BпјҺ500 mLе®№йҮҸ瓶 CпјҺжјҸж–— В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺиғ¶еӨҙж»ҙз®Ў (2)з”ЁжүҳзӣҳеӨ©е№із§°еҸ–ж°ўж°§еҢ–й’ пјҢе…¶иҙЁйҮҸдёә________gгҖӮ (3)дёӢеҲ—дё»иҰҒж“ҚдҪңжӯҘйӘӨзҡ„жӯЈзЎ®йЎәеәҸжҳҜ______________(еЎ«еәҸеҸ·)гҖӮ в‘ з§°еҸ–дёҖе®ҡиҙЁйҮҸзҡ„ж°ўж°§еҢ–й’ еӣәдҪ“пјҢж”ҫе…Ҙзғ§жқҜдёӯпјҢз”ЁйҖӮйҮҸи’ёйҰҸж°ҙжә¶и§Јпјӣ в‘ЎеҠ ж°ҙиҮіж¶ІйқўзҰ»е®№йҮҸ瓶йўҲеҲ»еәҰзәҝдёӢ1пҪһ2 cmж—¶пјҢж”№з”Ёиғ¶еӨҙж»ҙз®Ўж»ҙеҠ и’ёйҰҸж°ҙиҮіеҮ№ж¶ІйқўдёҺеҲ»еәҰзәҝзӣёеҲҮпјӣ в‘ўеҫ…еҶ·еҚҙиҮіе®Өжё©еҗҺпјҢе°Ҷжә¶ж¶ІиҪ¬з§»еҲ°500 mLе®№йҮҸ瓶дёӯпјӣ в‘Јзӣ–еҘҪ瓶еЎһпјҢеҸҚеӨҚдёҠдёӢйў еҖ’пјҢж‘ҮеҢҖпјӣ в‘Өз”Ёе°‘йҮҸзҡ„и’ёйҰҸж°ҙжҙ—ж¶Өзғ§жқҜеҶ…еЈҒе’ҢзҺ»з’ғжЈ’2пҪһ3ж¬ЎпјҢжҙ—ж¶Өж¶ІиҪ¬з§»еҲ°е®№йҮҸ瓶дёӯгҖӮ (4)еҰӮжһңе®һйӘҢиҝҮзЁӢдёӯзјәе°‘жӯҘйӘӨв‘ӨпјҢдјҡдҪҝй…ҚеҲ¶еҮәзҡ„NaOHжә¶ж¶Іжө“еәҰ________(еЎ«вҖңеҒҸй«ҳвҖқвҖңеҒҸдҪҺвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ (5)е®һйӘҢдёӨж¬Ўз”ЁеҲ°зҺ»з’ғжЈ’пјҢе…¶дҪңз”ЁеҲҶеҲ«жҳҜ__________________гҖҒ__________________гҖӮ
в‘ е®ҡе®№еҗҺпјҢеҠ зӣ–еҖ’иҪ¬ж‘ҮеҢҖеҗҺпјҢеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢеҸҲж»ҙеҠ и’ёйҰҸж°ҙиҮіеҲ»еәҰпјҢеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰзҡ„еҪұе“Қпјҡ____________гҖӮ в‘ЎжҹҗеҗҢеӯҰи§ӮеҜҹж¶Ійқўзҡ„жғ…еҶөеҰӮеӣҫжүҖзӨәпјҢеҲҷжүҖй…ҚеҲ¶зҡ„жә¶ж¶Ізҡ„жө“еәҰпјҡ__________гҖӮ
|
|
- 2020еұҠй«ҳдёүеҢ–еӯҰдёҖиҪ®еӨҚд№ еҹәжң¬жҰӮеҝөзү©иҙЁзҡ„йҮҸ
- 2017-2018е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲе®үеҫҪзңҒй»„еұұеёӮпјү
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢиҜҫж—¶з»ғд№ жЁЎжӢҹиҖғиҜ•и®ӯз»ғ
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖдёӢеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲеӣӣе·қзңҒйҳҶдёӯдёӯеӯҰпјү
- 2019еұҠй«ҳдёүдёӢеҶҢжЁЎжӢҹиҖғиҜ•еҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲйҷ•иҘҝзңҒжҰҶжһ—еёӮпјү
- иҚҶгҖҒиҚҶгҖҒиҘ„гҖҒе®ңеӣӣең°дёғж ЎпјҲиҘ„йҳідә”дёӯпјҢиҘ„йҳіеӣӣдёӯзӯүпјү2019е№ҙй«ҳдёүеҢ–еӯҰдёӢеҚҠе№ҙжңҲиҖғжөӢйӘҢеңЁзәҝеҒҡйўҳ
- жІіеҚ—зңҒй•ҝеһЈеёӮ第еҚҒдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- 2019-2020й«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲеӨ©жҙҘеёӮеҚ—ејҖдёӯеӯҰж»Ёжө·з”ҹжҖҒеҹҺеӯҰж Ўпјү