2017-2018年高一上半期期末考试化学试卷(安徽省黄山市)
| 1. 选择题 | 详细信息 |
|
下列有关物质性质和用途都正确,且有对应关系的是( ) A. SiO2能导电,可用于制造光导纤维 B. 金属Al硬度大,是良好的建筑材料 C. NH3易溶于水,可用作制冷剂 D. 浓硫酸有强氧化性,常温下可使铁钝化,所以可用钢制容器储存、运输 |
|
| 2. 选择题 | 详细信息 |
|
下列物质属于电解质的是( ) A. CaCO3 B. 稀硫酸 C. 液氨 D. NO2 |
|
| 3. 选择题 | 详细信息 |
|
下列情况与胶体性质有关的有 ①明矾净水 ②血液透析 ③在大江、大河的入海口处易形成三角洲 ④静电除尘 ⑤在雾天,打开车灯能看到一道粗的光柱 A. 2项 B. 3项 C. 4项 D. 全部都是 |
|
| 4. 选择题 | 详细信息 |
|
下列关于阿伏伽德罗常数的说法正确的是 A. 1mol Cl2与足量的Ca(OH)2溶液完全反应,转移电子的数目为2NA B. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA C. 9.2gNO2和N2O4的混合气体中原子总数为0.6NA D. 1L 1mol/L的乙醇溶液中含有的分子总数为NA |
|
| 5. 选择题 | 详细信息 |
|
下列微粒在所给条件下,一定可以大量共存的是( ) A. 透明溶液中:SCN-、NO3-、Na+、Fe3+ B. 遇酚酞显红色的溶液中:Cl2、Mg2+、I-、SO42- C. 与铝反应能产生大量氢气的溶液中:HCO3-、K+、Cl-、CH3COO- D. 酸性溶液中:Fe2+、Al3+、SO42-、NH4+ |
|
| 6. 选择题 | 详细信息 |
|
下列实验操作正确的是 A. 称量NaOH固体 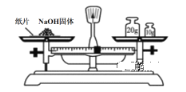 B. 用酒精提取碘水中的碘  C. 除去水中的氯化钠 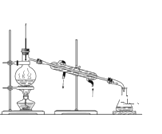 D. 从Y进气收集Cl2 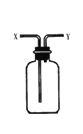 |
|
| 7. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 ( ) A. 酸性FeCl2溶液中加入双氧水:2Fe2++H2O2 =2Fe3++O2↑+2H+ B. 向KAl(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O C. 碳酸钙和盐酸反应: CO32-+2H+=H2O+CO2↑ D. 向铝中加入NaOH溶液:Al+4OH-= AlO2-+2H2↑ |
|
| 8. 选择题 | 详细信息 |
|
高铁酸钾(K2FeO4)是一种高效的净水剂,可用次氯酸盐氧化法制备,原理如下: ①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH.下列说法不正确的是( ) A. 反应①为氧化还原反应,反应②为复分解反应 B. 反应①中Na2FeO4是氧化产物 C. 反应①中氧化剂和还原剂的物质的量之比为2:3 D. 每生成1mol K2FeO4,转移电子的物质的量为3mol |
|
| 9. 选择题 | 详细信息 |
|
在给定条件下,下列选项所示物质间转化均能实现的是 A. CaCO3 B. Fe C. Al D. S |
|
| 10. 选择题 | 详细信息 |
|
Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( ) A. Na2O2中阴、阳离子的个数比为1:1 B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等 C. Na2O2与CO2反应过程中,只做氧化剂 D. Na2O2与SO2的漂白原理相同 |
|
| 11. 选择题 | 详细信息 |
|
下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是 ①向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ②向AlCl3溶液中通入过量的NH3 ③向Ba(OH)2溶液中通入过量CO2 ④向NaAlO2溶液中逐滴加入过量的盐酸 A. ①② B. ①③④ C. ①③ D. ③④ |
|
| 12. 选择题 | 详细信息 |
|
实验室欲用18mol/L的浓硫酸配制500mL 3mol/L的稀硫酸,下列说法正确的是( ) A. 应用量筒量取83.30mL的浓硫酸 B. 在烧杯中溶解后,应立即转移至容量瓶中 C. 加水定容时,若俯视刻度线,会使所配溶液浓度偏低 D. 若未洗涤烧杯内壁并将洗涤液转移至容量瓶中,会使所配溶液浓度偏低 |
|
| 13. 选择题 | 详细信息 |
|
以下除杂方式可行的是(括号内为杂质) A. N2(O2):通过灼热的铜网 B. CO2(CO):通入适量O2,充分燃烧 C. FeCl3(FeCl2):加入适量高锰酸钾氧化 D. Al2O3(Fe2O3):加入足量的NaOH溶液后,过滤 |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
下列实验现象和结论相符的是( )
|
||||||||||||||||
| 15. 选择题 | 详细信息 |
|
某容器真空时,称量其质量为60.4g,此容器充满N2时总质量为66.0g,在相同状况下, 充满另一气体时,总质量为74.6g,那么该气体可能是 A. Cl2 B. O2 C. SO2 D. HCl |
|
| 16. 选择题 | 详细信息 |
|
FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( ) A. 1:4 B. 1:5 C. 1:6 D. 1:7 |
|
| 17. 填空题 | 详细信息 |
|
(1)在SO2、SiO2、Na2O、Na2O2、Fe2O3、Al2O3中,属于碱性氧化物的是_____________; (2)石英耐高温,可制成石英坩埚,下列试剂可用石英坩埚加热的是________; A.NaOH B.CaCO3 C.Na2CO3 D.KHSO4 (3)奥运金牌“金镶玉”环形碧玉由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用氧化物的形式可表示为________________________; (4)治疗胃酸(主要成分为HCl)过多的常用药物有小苏打、胃舒平等。 ①请写出小苏打和胃酸反应的离子反应方程式_________________________; ②胃舒平主要成分为Al(OH)3,若中和等量的酸,消耗小苏打和Al(OH)3的物质的量之比为___________。 |
|
| 18. 填空题 | 详细信息 |
|
(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题: ①在该反应中0.2mol高锰酸钾可得到1mol电子,该反应的还原产物为________(写化学式) ②请补全并配平该反应方程式: ___H2C2O4+ KMnO4+ H2SO4 → K2SO4+ + CO2↑ + H2O (2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:  根据实验现象回答: 该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。 |
|
| 19. 实验题 | 详细信息 |
某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。 (1)A中发生反应的化学反应方程式为_________________________ (2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题: ①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ; ②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________; ③装置F中球形干燥管的作用是____________________________; (3)储气瓶b内盛放的试剂是______________________________; (4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________ |
|
| 20. 填空题 | 详细信息 | ||||||
|
SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。 (1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。 (2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________; 已知:
|
|||||||
| 21. 填空题 | 详细信息 |
|
向Cu和CuO组成的混合物中,加入90mL5.0mol·L1稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 2.24L。请回答以下问题: (1)写出Cu与稀硝酸反应的离子方程式 _____________________________________; (2)原混合物中铜的物质的量为 ________mol,氧化铜的物质的量为______mol; (3)若要将生成的NO气体完全转化为硝酸,需通氧气______L(标准状况下)。 |
|
最近更新




