2019еұұиҘҝй«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҪ“ж°ҙеҸ‘з”ҹеҰӮдёӢеҸҳеҢ–ж—¶пјҡH2O(s)вҶ’H2O(l)вҶ’H2O(g)пјҢжӯӨиҝҮзЁӢзҡ„в–іSпјҲзҶөеҸҳпјүеҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ ( гҖҖгҖҖ)В В В В В В В В В В В A.>0В В В В В В В В В В В В B.<0В В В В В В В В В C.дёҚеҸҳВ В В В В В D.ж— жі•еҲӨж–ӯ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶ІдёҖе®ҡе‘ҲдёӯжҖ§зҡ„жҳҜ (гҖҖгҖҖ )В В В В В В В В В В В A.pHпјқ7 В В В В В В В В В В В В В В В В В В В В B.c(HпјӢ)пјқc(OHпјҚ)зҡ„жә¶ж¶І
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјүВ В В В В В В В В В В A.д»ҘдёӢз”ҹжҙ»еёёи§Ғзү©иҙЁзҡ„pHз”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёәпјҡжҙҒеҺ•зҒөпјңзҷҪзі–ж°ҙпјңеҺЁжҲҝжё…жҙҒеүӮ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дәӢе®һеҸҜз”ЁеӢ’еӨҸзү№еҲ—еҺҹзҗҶи§ЈйҮҠзҡ„жҳҜпјҲВ В пјүВ В В В В В В В В В В A.дҪҝз”ЁеӮ¬еҢ–еүӮжңүеҲ©дәҺеҠ еҝ«еҗҲжҲҗж°ЁеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ејҸеӯҗеұһдәҺж°ҙи§ЈеҸҚеә”пјҢдё”жә¶ж¶Іе‘Ҳй…ёжҖ§зҡ„жҳҜ (В В В )В В В В В В В В В В В A.HCO3- + H2O
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—еҲӨж–ӯе…ЁйғЁжӯЈзЎ®зҡ„дёҖз»„жҳҜпјҡпјҲВ В пјү
A. AВ В В В В В В B. BВ В В В В В В C.В CВ В В В В В В В D.В D
|
|||||||||||||||||||||
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁC(s)пјӢCO2(g)пјқ2CO(g)еҸҚеә”дёӯпјҢеҸҜдҪҝеҸҚеә”йҖҹзҺҮеўһеӨ§зҡ„жҺӘж–ҪжҳҜпјҲВ В В пјү A. в‘ в‘ўв‘ҘВ В В В В В B. в‘ в‘ўв‘ЈВ В В В В C.в‘Ўв‘Јв‘ҘВ В В В В В D.в‘ўв‘Өв‘Ҙ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
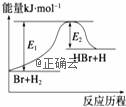
еҸӮз…§еҸҚеә”Br+H2 A.иҜҘеҸҚеә”зҡ„еҸҚеә”зғӯв–іH=E2п№ЈE1В В В В В В В В В В B.жӯЈеҸҚеә”дёәеҗёзғӯеҸҚеә”
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еүҚеӣҪйҷ…з©әй—ҙз«ҷеӨ„зҗҶCO2еәҹж°”ж¶үеҸҠзҡ„еҸҚеә”дёәCO2+4H2 A.йҖҡиҝҮдҪҝз”Ёй’ҢеӮ¬еҢ–еүӮиғҪдҪҝCO2 100%иҪ¬еҢ–дёәCH4
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёи’ёйҰҸж°ҙйҖҗжӯҘзЁҖйҮҠ0.2 mol/Lзҡ„зЁҖж°Ёж°ҙж—¶пјҢиӢҘжё©еәҰдёҚеҸҳпјҢеңЁзЁҖйҮҠиҝҮзЁӢдёӯдёӢеҲ—ж•°жҚ®е§Ӣз»ҲдҝқжҢҒеўһеӨ§и¶ӢеҠҝзҡ„жҳҜ(гҖҖгҖҖ )В В В В В В В В В В В A.c(OH-)В В В В B.c(NH4+)В В В C.c(NH3В·H2O)В В В D.c(NH4пјӢ)/c(NH3В·H2O)
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
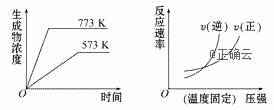
дёӢеҲ—еҸҚеә”дёӯз¬ҰеҗҲдёӢеҲ—еӣҫеғҸзҡ„жҳҜ(В В В ) A.N2(g)+3H2(g)
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В )В В В В В В В В В В В A.жҹҗжё©еәҰдёӢзәҜж°ҙpHпјқ6пјҢеҲҷеңЁиҜҘжқЎд»¶дёӢpHпјқ4зҡ„йҶӢй…ёе’ҢpHпјқ10зҡ„NaOHдёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰзӣёеҗҢ C.е·ІзҹҘSзҡ„зҮғзғ§зғӯдёәQ kJ/molпјҢеҲҷS(s)пјӢ 2NH3
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠ0.02mol/L CH3COOHжә¶ж¶Іе’Ң0.01mol/L NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢеҲҷж··еҗҲжә¶ж¶Ідёӯеҫ®зІ’жө“еәҰе…ізі»жӯЈзЎ®зҡ„жҳҜпјҲ В В пјүВ В В В В В В В В В В A.c(CH3COOп№Јпјүпјңc(Na+пјүВ В В В В В В В В В В В В В B.c(CH3COOHпјүпјһc(CH3COO-пјү
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Ідёӯжңүе…ізү©иҙЁзҡ„йҮҸжө“еәҰе…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В пјүВ В В В В В В В В В В A.pH=4зҡ„0.1mol/LNaHC2O4жә¶ж¶ІcпјҲHC2O4п№ЈпјүпјһcпјҲH+пјүпјһcпјҲH2C2O4пјүпјһcпјҲC2O42п№Јпјү B.Na2CO3жә¶ж¶ІдёӯпјҡcпјҲNa+пјү=2cпјҲCO32п№Јпјү+2cпјҲHCO3п№Јпјү D. е®Өжё©дёӢпјҢpH=1зҡ„CH3COOHжә¶ж¶Іе’ҢpH=13зҡ„NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰзҡ„еӨ§е°ҸйЎәеәҸпјҡcпјҲNa+пјүпјһcпјҲCH3COOп№ЈпјүпјһcпјҲOHп№ЈпјүпјһcпјҲH+пјү
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
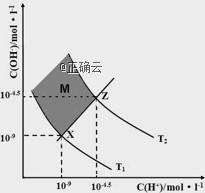
дёӢеӣҫиЎЁзӨәжә¶ж¶ІдёӯcпјҲH+пјүе’ҢcпјҲOHп№Јпјүзҡ„е…ізі»пјҢдёӢеҲ—еҲӨж–ӯй”ҷиҜҜзҡ„жҳҜпјҲВ В пјүгҖӮ
A.дёӨжқЎжӣІзәҝй—ҙд»»ж„ҸзӮ№еқҮжңү B.MеҢәеҹҹеҶ…д»»ж„ҸзӮ№еқҮжңү D.XZзәҝдёҠд»»ж„ҸзӮ№еқҮжңүpHпјқ7
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||||||||||
|
жұҪиҪҰе°ҫж°”еҮҖеҢ–еҷЁдёӯеҸ‘з”ҹзҡ„еҸҚеә”дёәВ 2NO(g)+2CO(g) вҮҢ N2(g)+2CO2(g)гҖӮдёҖе®ҡжё©еәҰдёӢ,еңЁдёүдёӘдҪ“з§ҜеқҮдёә1.0Lзҡ„жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹдёҠиҝ°еҸҚеә”,жөӢеҫ—жңүе…іе®һйӘҢж•°жҚ®еҰӮиЎЁ:дёӢеҲ—иҜҙжі•жӯЈзЎ®жҳҜ(В В В )В
A.В В В В В В иҜҘеҸҚеә”зҡ„в–іSпјң0гҖҒв–іHпјһ0 B.В В В В В В е®№еҷЁIдёӯиҫҫеҲ°е№іиЎЎжүҖйңҖж—¶й—ҙ2s,еҲҷv(N2)=0.06mol/(LВ·s)В C.В В В В В В иӢҘиө·е§Ӣж—¶еҗ‘Iдёӯе……е…ҘNOгҖҒCOгҖҒN2гҖҒCO2еҗ„0.1mol,ејҖе§Ӣж—¶v(жӯЈ)пјһv(йҖҶ) D.В В В В В В иҫҫеҲ°е№іиЎЎж—¶,дҪ“зі»дёӯc(CO)е…ізі»: c(CO,е®№еҷЁв…Ў) пјһ2 c(CO,е®№еҷЁв… )
|
|||||||||||||||||||||||||||||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
|
жҹҗеӯҰз”ҹз”Ё0.2000mol/Lзҡ„ж ҮеҮҶNaOHжә¶ж¶Іж»ҙе®ҡжңӘзҹҘжө“еәҰзҡ„зӣҗй…ёпјҢе…¶ж“ҚдҪңжӯҘйӘӨеҰӮдёӢпјҡв‘ йҮҸеҸ–20.00mLеҫ…жөӢж¶ІжіЁе…ҘжҙҒеҮҖзҡ„й”ҘеҪўз“¶дёӯпјҢ并еҠ е…Ҙ3ж»ҙй…ҡй…һжә¶ж¶ІпјҺ в‘Ўз”Ёж ҮеҮҶж¶Іж»ҙе®ҡиҮіз»ҲзӮ№пјҢи®°еҪ•ж»ҙе®ҡз®Ўж¶ІйқўиҜ»ж•°пјҢжүҖеҫ—ж•°жҚ®еҰӮдёӢиЎЁпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүжӯҘйӘӨв‘ дёӯпјҢйҮҸеҸ–20.00mLеҫ…жөӢж¶Іеә”дҪҝз”ЁВ В В В В В В пјҲеЎ«д»ӘеҷЁеҗҚз§°пјүпјҢиӢҘеңЁй”ҘеҪўз“¶иЈ…ж¶ІеүҚж®Ӣз•ҷе°‘йҮҸи’ёйҰҸж°ҙпјҢе°ҶдҪҝжөӢе®ҡз»“жһңВ В В В В В В пјҲеЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјүпјҺ пјҲ2пјүжӯҘйӘӨв‘ЎдёӯпјҢж»ҙе®ҡж—¶зңјзқӣеә”жіЁи§ҶВ В В В В В пјҲеЎ«д»ӘеҷЁеҗҚз§°пјүпјҢеҲӨж–ӯеҲ°иҫҫж»ҙе®ҡз»ҲзӮ№зҡ„дҫқжҚ®жҳҜ _____________________________________________________________пјҲ3пјү第дёҖж¬Ўж»ҙе®ҡи®°еҪ•зҡ„NaOHжә¶ж¶Ізҡ„дҪ“з§ҜжҳҺжҳҫеӨҡдәҺеҗҺдёӨж¬ЎпјҢе…¶еҸҜиғҪзҡ„еҺҹеӣ жҳҜпјҲеЎ«еӯ—жҜҚпјүВ В В В В В В В AпјҺж»ҙе®ҡеүҚж»ҙе®ҡз®Ўе°–еҳҙжңүж°”жіЎпјҢж»ҙе®ҡз»“жқҹж— ж°”жіЎВ В BпјҺй”ҘеҪўз“¶иЈ…ж¶ІеүҚз”Ёеҫ…жөӢж¶Іж¶Ұжҙ— CпјҺNaOHж ҮеҮҶж¶Ідҝқеӯҳж—¶й—ҙиҝҮй•ҝпјҢжңүйғЁеҲҶNa2CO3з”ҹжҲҗВ DпјҺж»ҙе®ҡз»ҲзӮ№ж—¶пјҢдҝҜи§ҶиҜ»ж•° пјҲ4пјүж №жҚ®дёҠиЎЁи®°еҪ•ж•°жҚ®пјҢйҖҡиҝҮи®Ўз®—еҸҜеҫ—иҜҘзӣҗй…ёзҡ„жө“еәҰдёәВ В В В В В В В В mol/L
|
|||||||||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
е®һж–Ҫд»ҘиҠӮзәҰиғҪжәҗе’ҢеҮҸе°‘еәҹж°”жҺ’ж”ҫдёәеҹәжң¬еҶ…е®№зҡ„иҠӮиғҪеҮҸжҺ’ж”ҝзӯ–пјҢжҳҜеә”еҜ№е…Ёзҗғж°”еҖҷй—®йўҳгҖҒе»әи®ҫиө„жәҗиҠӮзәҰеһӢгҖҒзҺҜеўғеҸӢеҘҪеһӢзӨҫдјҡзҡ„еҝ…然йҖүжӢ©гҖӮеҢ–е·ҘиЎҢдёҡзҡ„еҸ‘еұ•еҝ…йЎ»з¬ҰеҗҲеӣҪ家иҠӮиғҪеҮҸжҺ’зҡ„жҖ»дҪ“иҰҒжұӮгҖӮиҜ•иҝҗз”ЁжүҖеӯҰзҹҘиҜҶпјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡВ В В пјҲ1пјүе·ІзҹҘжҹҗжё©еәҰдёӢжҹҗеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°иЎЁиҫҫејҸдёәпјҡK=c(H2O)/[ c(CO)В·c(H2)]жүҖеҜ№еә”зҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸдёәпјҡ________гҖӮВ В В пјҲ2пјүе·ІзҹҘеңЁдёҖе®ҡжё©еәҰдёӢпјҡ в‘ C(s)+CO2(g) пјҲ3пјүз…ӨеҢ–е·ҘйҖҡеёёйҖҡиҝҮз ”з©¶дёҚеҗҢжё©еәҰдёӢе№іиЎЎеёёж•°д»Ҙи§ЈеҶіеҗ„з§Қе®һйҷ…й—®йўҳгҖӮе·ІзҹҘзӯүдҪ“з§Ҝзҡ„дёҖж°§еҢ–зўіе’Ңж°ҙи’ёж°”иҝӣе…ҘеҸҚеә”еҷЁж—¶пјҢеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ CO(g)+H2O(g)
иҜҘеҸҚеә”зҡ„жӯЈеҸҚеә”ж–№еҗ‘жҳҜ________еҸҚеә”пјҲеЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқпјүпјҢиӢҘеңЁ500в„ғж—¶иҝӣиЎҢпјҢи®ҫиө·е§Ӣж—¶COе’ҢH2Oзҡ„иө·е§Ӣжө“еәҰеқҮдёә0.020 mol/LпјҢеңЁиҜҘжқЎд»¶дёӢпјҢCOзҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёәпјҡ________гҖӮВ В В
|
|||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
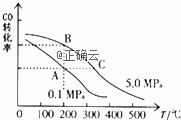
пјҲ1пјүз”ІйҶҮжҳҜеҸҜеҶҚз”ҹиғҪжәҗпјҢе…·жңүејҖеҸ‘еә”з”Ёзҡ„е№ҝйҳ”еүҚжҷҜпјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ В дёҖе®ҡжё©еәҰдёӢпјҢеңЁдёҖжҒ’е®№зҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢз”ұCOе’ҢH2еҗҲжҲҗз”ІйҶҮпјҡ в‘ЎCOзҡ„е№іиЎЎиҪ¬еҢ–зҺҮпјҲОұпјүдёҺжё©еәҰгҖҒеҺӢејәзҡ„е…ізі»еҰӮдёҠеӣҫжүҖзӨәпјҺAгҖҒBдёӨзӮ№зҡ„е№іиЎЎеёёж•°KпјҲAпјү________В KпјҲBпјүпјҲеЎ«вҖңпјһвҖқгҖҒвҖң=вҖқжҲ–вҖңпјңвҖқпјүпјҺВ пјҲ2пјүе·ІзҹҘ25в„ғеҗҲжҲҗж°ЁеҸҚеә”дёӯпјҢ1mol N2е®Ңе…ЁиҪ¬еҢ–дёәNH3ж—¶йҮҠж”ҫзҡ„иғҪйҮҸдёә92.4 kJгҖӮзҺ°е°Ҷ1mol N2е’Ң3mol H2ж··еҗҲзҪ®дәҺ2LеҜҶй—ӯе®№еҷЁдёӯпјҢеҸҚеә”иҝӣиЎҢеҲ°2sжң«жөӢеҫ—NH3дёә0.4molгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
пјҲ1пјүжҹҗжё©еәҰдёӢпјҢзәҜж°ҙдёӯcпјҲH+пјү=2Г—10п№Ј7 mol/LпјҢ еҲҷжӯӨжё©еәҰдёӢж°ҙзҡ„зҰ»еӯҗз§Ҝдёә________пјҺиӢҘжё©еәҰдёҚеҸҳпјҢж»ҙе…ҘзЁҖзӣҗй…ёдҪҝcпјҲH+пјү=5Г—10п№Ј4 mol/LпјҢ еҲҷжӯӨж—¶cпјҲOHп№Јпјү=________пјҺз”ұж°ҙз”өзҰ»дә§з”ҹзҡ„cпјҲH+пјүдёә________пјҢжӯӨж—¶жё©еәҰ________ пјҲеЎ«вҖңй«ҳдәҺвҖқгҖҒвҖңдҪҺдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјү25В°CпјҺВ В В пјҲ2пјүв‘ 25в„ғж—¶пјҢNaHSO3жә¶ж¶Іе‘Ҳ_______жҖ§пјҢеҺҹеӣ жҳҜ __________пјҲз”ЁзҰ»еӯҗж–№зЁӢејҸз»“еҗҲж–Үеӯ—еӣһзӯ”пјү в‘Ўеёёжё©дёӢпјҢpH=9зҡ„NaOHдёҺpH=13зҡ„NaOHзӯүдҪ“з§Ҝж··еҗҲеҗҺжә¶ж¶Ізҡ„pH=________пјӣ пјҲ3пјү25в„ғж—¶пјҢйғЁеҲҶзү©иҙЁзҡ„з”өзҰ»е№іиЎЎеёёж•°еҰӮиЎЁжүҖзӨәпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
в‘ CH3COOHгҖҒH2CO3гҖҒHClOзҡ„й…ёжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸдёә________гҖӮ
|
|||||||||
- е®үеҫҪзңҒзҡ–еҢ—еҗҚж Ў2020-2021е№ҙй«ҳдәҢдёҠжңҹ第дёҖж¬ЎиҒ”иҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- ж№–еҚ—зңҒй•ҝжІҷеёӮеҚ—йӣ…дёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдәҢеҗҺеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙж№–еҢ—зңҒйҡҸе·һеёӮжӣҫйғҪдёҖдёӯпјү
- еұұдёңзңҒиҒҠеҹҺеёӮд№қж Ў2020-2021е№ҙй«ҳдәҢдёҠеҶҢ第дёҖж¬ЎејҖеӯҰиҒ”иҖғеҢ–еӯҰиҜ•еҚ·еңЁзәҝз»ғд№
- 2019-2020е№ҙй«ҳдёҖдёҠеҚҠе№ҙ12жңҲд»ҪжңҲиҖғеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеұұдёңзңҒдёҙжІӮеёӮжІӮж°ҙеҺҝ第дёҖдёӯеӯҰпјү
- 2018е№ҙ11жңҲжөҷжұҹзңҒжҷ®йҖҡй«ҳж ЎжӢӣз”ҹйҖүиҖғ科зӣ®иҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠ
- еҢ—дә¬еёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- ж№–еҚ—й«ҳдёҖеҢ–еӯҰ2020е№ҙдёӢеҶҢжңҲиҖғжөӢйӘҢеңЁзәҝзӯ”йўҳ