2019福建高三上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( ) A. 44gCO2与C3H8的混合物中含有共用电子对数为9NA B. 将标准状况下2.24LSO2通入水中完全溶解,溶液中HSO32-与SO32-总数为0.1NA C. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA D. 标准状况下,8.96L的平均相对分子质量为3.5的H2与D2混合物中含中子数0.3NA
|
|
| 2. | 详细信息 |
|
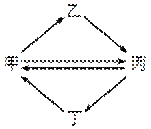
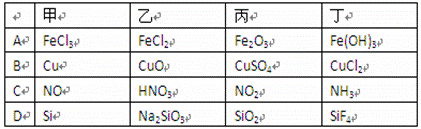
下列各组物质按右图所示转化关系每一步都能一步实现的是( )
|
|
| 3. | 详细信息 |
|
常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4; 第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。 下列判断不正确的是( ) A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO) B. 第一阶段应选择稍高于42.2℃的反应温度 C. 第二阶段,230℃时Ni(CO)4分解率较高 D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
|
|
| 4. | 详细信息 | ||||||||||
|
一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g)
A. 0〜t1min,v(NH3)= B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1 C. N2(g)+3H2(g) D.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
|
|||||||||||
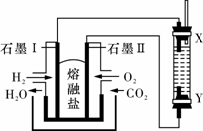
| 5. | 详细信息 |
|
A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2- B. X是铁电极 C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L D. 若将电池两极所通气体互换,X、Y两极材料也要互换。
|
|
| 6. | 详细信息 | ||||||||||
|
已知部分弱酸的电离平衡常数如下表所示:
下列离子方程式正确的是( ) A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3- C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
|
|||||||||||
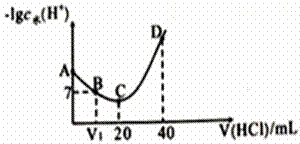
| 7. | 详细信息 |
|
羟氨(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等 B. A点对应溶液的pH=9.5 C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH) D. C点时,溶液呈酸性
|
|
| 8. | 详细信息 |
|
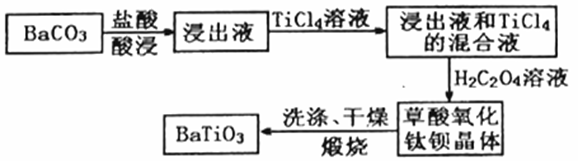
钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC 热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)·4H2O; ②25℃时,BaCO3的溶度积Ksp=2.58×10-9; (1)BaTiO3中Ti元素的化合价为:_______________。 (2)用盐酸酸浸时发生反应的离子方程式为:________________________________________。 (3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。 ①过滤操作中使用的玻璃仪器有_______________________________________。 ②如何证明晶体已洗净?__________________________________________。 (4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是(用化学方程式解释):______________________________________。 (5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___________。 (6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c([Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为____mol/L。
|
|
| 9. | 详细信息 |
|
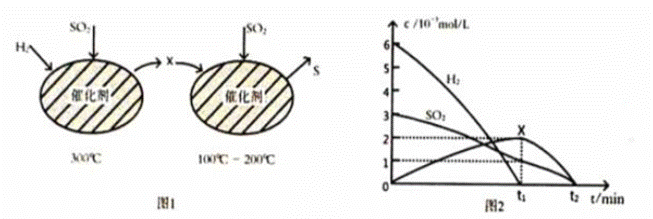
SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。 (1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。 己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________ 。 (2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。 ②总反应的化学方程式为__________________________________________________________。 (3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) ①该反应的△H _________________________ 0 (填“>”或“<”) ②计算700℃该反应的平衡常数为____________________ 。
|
|
| 10. | 详细信息 |
|
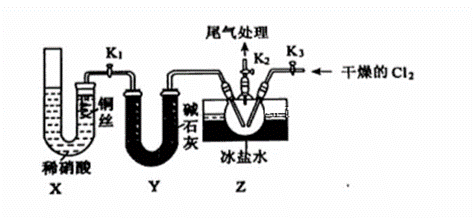
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。 (1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
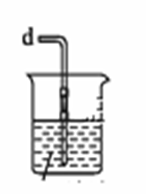
①制备NO发生装置可以选用__________(填写字母代号),请写出发生反应的离子方程式:__________。 ②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ ___________(按气流方向,用小写字母表示)。 (2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
①实验室也可用X装置制备NO,X装置的优点为________________________________。 ②检验装置气密性并装入药品,打开K2,然后再打开 ____________,通入一段时间气体,其目的为___________________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。 ③若无装置Y,则Z中NOCl可能发生反应的化学方程式为________________________。 ④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 __________溶液。 (3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
|
|
| 11. | 详细信息 |
|
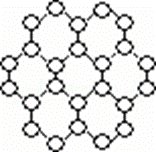
(1)下列有关石墨烯说法正确的是________________。 A.键长:石墨烯>金刚石 B.石墨烯分子中所有原子可以处于同一平面 C.12g石墨烯含 D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力 (2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。 ①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为_____________;第四周期元素中,最外层电子数与铜相同的元素还有________________________。 ②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______________________________。
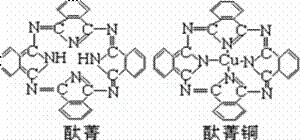
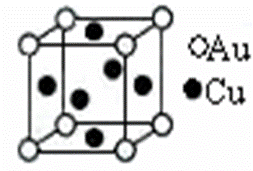
a.甲烷 b.二氯甲烷 c.苯 d.乙醇 ④酞菁与酞菁铜染料分子结构如图,酞菁分子中碳原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为________________。 ⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点):
它的化学式可表示为_____;在Au周围最近并距离相等的Cu有_____个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为___________________g/cm3。(阿伏伽德罗常数用NA表示)
|
|