湖南省娄底市第一中学2020-2021年高二上半期开学考试化学在线考试题带答案和解析
| 1. 选择题 | 详细信息 |
|
对下列各项事实的判断错误的是 A.近年热议的“抗糖”一词中的“糖”,指的是六大营养物质之一的糖类。糖类由C、H、O三种元素组成 B.屠呦呦因发现青蒿素(C15H22O5)荣获诺贝尔奖。青蒿素是可以人工合成的有机高分子化合物 C.“自热火锅”极大的方便了人们的生活,自热包的主要成分为CaO。使用时只需加水即可加热“火锅” D.新型冠状病毒(2019-nCoV)平均直径约0.1微米。用滤纸做的“口罩”无法隔离新型冠状病毒 |
|
| 2. 选择题 | 详细信息 |
|
下列化学用语或命名正确的是( ) A.次氯酸的结构式:H-Cl-O B.含有10个中子的氧原子的符号: C.  D.  |
|
| 3. 选择题 | 详细信息 |
|
随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N A.H3是氢元素的一种核素 B.O2与O4属于同素异形体 C.C60的摩尔质量为720 D.N |
|
| 4. 选择题 | 详细信息 |
|
下列说法中正确的是 A.离子化合物中一定含有离子键 B.单质分子中均存在化学键 C.HF分子间存在氢键,故氟化氢比氯化氢更稳定 D.NaCl和HCl溶于水破坏相同的作用力 |
|
| 5. 选择题 | 详细信息 |
|
X原子的核电荷数为a,它的阴离子Xm-与Y原子的阳离子Yn+的电子层 结构相同,则Y原子的核电荷数为( ) A.a+m+n B.a-m-n C.m+n-a D.m-n-a |
|
| 6. 选择题 | 详细信息 |
|
已知:(1)H2(g)+ (2)2H2(g)+O2(g)= 2H2O(g) ΔH2=b kJ·mol-1 (3)H2(g)+ (4)2H2(g)+O2(g)= 2H2O(l) ΔH4=d kJ·mol-1下列关系式中正确的是( ) A.a<c<0 B.2a=b<0 C.b>d>0 D.2c=d>0 |
|
| 7. 选择题 | 详细信息 |
|
在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为CO(g)+H2S(g) A.正、逆反应速率都等于零 B.CO、H2S、COS、H2的浓度相等 C.CO、H2S、COS、H2在容器中共存 D.CO、H2S、COS、H2的浓度均不再变化 |
|
| 8. 选择题 | 详细信息 |
|
下列说法或表示方法正确的是 A.500℃、30 MPa下,将0.5 mol N2 (g)和1.5 mol H2 (g)置于密闭容器中充分反应生成NH3 (g)放热19.3kJ,其热化学方程式为:N2 (g)+3H2 (g)⇌2NH3 (g) △H=-38.6 kJ·mol-1 B.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ D.在25 ℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 |
|
| 9. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是 A.元素的非金属性:X>Y B.简单离子的还原性:Y>X>W C.简单离子的半径:W>X>Y>Z D.氢化物水溶液的酸性:Y>W |
|
| 10. 选择题 | 详细信息 | |||||||||||||||
根据元素周期律,由下列事实进行归纳推测,推测不合理的是
|
||||||||||||||||
| 11. 选择题 | 详细信息 |
|
在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变 ④混合气体的平均相对分子质量不变 ⑤B 的质量不变 ⑥容器内 C、D 两种气体的浓度相等 A.①②④⑤⑥ B.①②④⑤ C.①②③④⑤ D.①②⑤⑥ |
|
| 12. 选择题 | 详细信息 |
一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述正确的是 A.Y的最高化合价氧化物的水化物为强酸 B.W元素的金属性大于Z C.该化合物中,W、X、Y之间均为离子键 D.X的氟化物XF3中原子均为8电子稳定结构 |
|
| 13. 选择题 | 详细信息 |
|
下列装置可以构成原电池的是 ( ) A.  B.  C.  D.  |
|
| 14. 选择题 | 详细信息 |
|
下列反应属于取代反应的是 A.乙醇与氧气反应生成乙醛 B.十六烷裂化生成辛烷和辛烯 C.甲烷与氯气反应生成四氯化碳 D.乙烯与溴反应生成1,2-二溴乙烷 |
|
| 15. 选择题 | 详细信息 |
|
下列说法中正确的一组是( ) A.H2和D2互为同位素 B.  和 和 互为同分异构体 互为同分异构体C.正丁烷和异丁烷是同系物 D.  和 和 是同一种物质 是同一种物质 |
|
| 16. 选择题 | 详细信息 |
科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如图所示,下列说法正确的是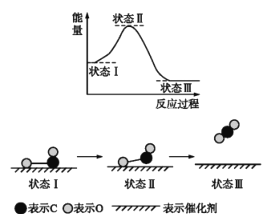 A.状态I→状态III表示CO与O2反应的过程 B.CO和O生成了含有极性共价键的CO2 C.在该过程中,CO断键形成C和O D.CO和O生成CO2是吸热反应 |
|
| 17. 选择题 | 详细信息 |
|
下列各反应对应的离子方程式正确的是( ) A. 向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O B. 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- C. 向NaHSO4溶液中加足量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O D. 向含3molNaClO溶液中通入1mol SO2:3ClO-+H2O+SO2=2HClO+SO42-+Cl- |
|
| 18. 选择题 | 详细信息 | ||||||||||||||||
在标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知几种化学键的键焓如表所示:
|
|||||||||||||||||
| 19. 选择题 | 详细信息 |
|
根据碘与氢气反应的热化学方程式: ①I2(g)+H2(g) ②I2(s)+H2((g) 下列判断正确的是 A.254gI(g)中通入2gH2(g),反应放热9.48kJ B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ C.反应②的反应物总能量比反应①的反应物总能量低 D.反应①的生成物比反应②的生成物稳定 |
|
| 20. 选择题 | 详细信息 |
|
下列说法或表示方法中正确的是( ) A.等质量的硫蒸气和固态硫分别完全燃烧,后者放出的热量多 B.1mol氢气完全燃烧生成液态水比生成气态水的放出的热量少 C.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0 D.已知中和热ΔH=-57.3 kJ·mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3kJ |
|
| 21. | 详细信息 |
|
A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题: (1)写出B、C、E元素的名称B____、E______。 (2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为______。 (3)可以验证C和F两种元素非金属性强弱的结论是(填编号)_______ ①比较这两种元素常见单质的熔点 ②比较这两种元素的单质与氢气化合的难易程度 ③比较这两种元素的气态氢化物的还原性 (4) A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为__________________ 。 (5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为____________。 |
|
| 22. | 详细信息 |
|
正确认识和使用电池有利于我们每一个人的日常生活。 I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(己知石墨只起导电作用,质子交换膜只允许H+通过)。  (1)石墨2为_____(填“正极”或“负极”),负极的电极反应式为________。 (2)反应的总方程式为______________。 (3)放电时H+迁移向______。(填“正极”或“负极”) (4)某同学关于原电池的笔记中,不合理的有_____。 ①原电池两电极材料可以相同 ②原电池负极材料参与反应,正极材料都不参与反应 ③Fe-浓硝酸-Cu原电池,Fe是负极 ④原电池是将化学能转变为电能的装置 Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。 (1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_______ 。 (2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子的物质的量为_____________。 |
|
| 23. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||
|
已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00 mol·L-1、2.00 mol·L-1两种浓度,每次实验稀盐酸的用量为25.00 mL,锌有细颗粒与粗颗粒两种规格,用量为6.50 g。实验温度为298 K、308 K。 (1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
|
|||||||||||||||||||||||||||||||||||||||||||||




