四川省凉山州2021年高考化学二模试卷
四川省凉山州2021年高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活密切相关。下列说法正确的是( )
A . 雷雨天闪电时空气中有臭氧(O3)生成,O2和O3的相互转化是物理变化
B . 新型冠状病毒具有极强的传染性,可用84消毒液、过氧乙酸等进行环境消毒,是利用了其强氧化性
C . 以煤炭为主要燃料的地区,降落后的酸雨中的主要酸性物质是HNO3
D . 通常用石油的年产量来衡量一个国家的石油化学工业发展水平
|
|
| 2. 单选题 | |
|
下列说法错误的是( )
A . 植物油氢化过程中发生了加成反应
B . CH3CHO的球棍模型为
|
|
| 3. 单选题 | |
|
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A . 常温常压下,1.0molFe和足量浓硝酸混合反应,转移电子数为3NA
B . 等质量的乙烯和丙烯中含有的共用电子对数相等
C . 常温下,1.0LpH=13的Ba(OH)2溶液中含OH-的数目为0.1NA
D . 0.1mol的11B中,含有0.6NA个中子
|
|
| 4. 单选题 | |||||||||||||||||||||
|
根据下列实验操作和现象所得结论正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A . X、Y、Z、W的原子半径依次减小
B . 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
C . W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D . W与X形成的化合物只含离子键
|
|
| 6. 单选题 | |
|
臭氧(O3)是一种强氧化剂,常用于消毒灭菌等,可用下图电解稀硫酸制得O3 , 下列说法正确的是( )
A . 图中特制惰性电极C为阳极
B . 电解一段时间后停止电解,溶液的pH显著变大
C . 电解开始后电子的移动方向为:A→C→D→B
D . 电解一段时间后E、F处分别收集到xL和yL气体(标准状况),则F处收集的气体中O3所占的体积分数为
 (忽略O3的分解) (忽略O3的分解)
|
|
| 7. 单选题 | |
|
下列有关电解质溶液的叙述错误的是( )
A . 25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=l×10-10mol·L-1
B . 25℃时,将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
C . 25℃时,pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为1×10-11mol·L-1
D . 温度一定时,CH3COOH和CH3COONa的混合溶液中,
 = = 
|
|
| 8. 综合题 | |
|
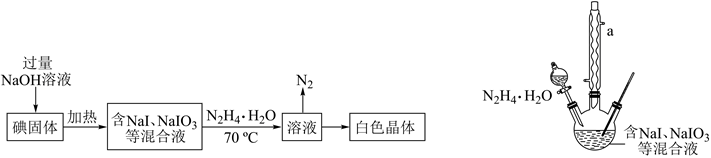
碘化钠在有机合成、医疗及食品等方面用途广泛,有多种制备方法,下图是“水合肼还原法”制备碘化钠的一种方案。已知:3I2+6NaOH=5NaI+NaIO3+3H2O,N2H4·H2O有还原性,沸点118℃,100℃开始分解。
|
|
| 9. 综合题 | |
|
工业上以软锰矿(MnO2)为原料制备高锰酸钾(KMnO4)的流程如下:
回答下列问题:
|
|
| 10. 综合题 | ||||||||||||||||||||||
|
乙苯脱氢法是生产苯乙烯的主要方法,目前世界上大约90%的苯乙烯采用该法生产,它以乙苯为原料,在催化剂作用下脱氢生成苯乙烯和氢气,反应的方程式如下:
回答下列问题:
|
||||||||||||||||||||||
高中化学 试卷推荐
- 2015年河南省八市重点高中高考化学模拟试卷(5月份)
- 陕西省安康市2019-2020学年高二下学期化学期末考试试卷
- 江苏省盐城市2016-2017学年高一下学期化学期末考试试卷
- 广东省惠州市惠阳高级中学2016-2017学年高二上学期化学期中考试试卷
- 2016-2017学年山东省烟台市高三上学期期中化学试卷
- 高中化学人教版(2019)必修第一册第四章第三节 化学键
- 2020年高考理综化学真题试卷(新课标Ⅲ)
- 2016-2017学年湖北省鄂东南省级示范高级中学高一下学期期中化学试卷
- 黑龙江省七台河市第一中学2019-2020学年高一下学期化学期中考试试卷
- 2016-2017学年四川省资阳市简阳市阳安中学高二上学期期中化学试卷
- 2015-2016学年四川省广安市华蓥市高一下学期期末化学试卷
- 2015-2016学年四川省宜宾市普通高中高二上学期期末化学试卷
最近更新





 +2.86,根据(1)中实验结果推断该式是否正确,并说明理由。
+2.86,根据(1)中实验结果推断该式是否正确,并说明理由。




