2017年陕西省榆林市高考化学一模试卷
2017年陕西省榆林市高考化学一模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学在生产和日常生活中有着重要作用,下列有关说法不正确的是( )
A . 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂
B . “地沟油”禁止食用,但可以用来制肥皂
C . 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D . 利用粮食酿酒经过了淀粉→葡糖糖→乙醇的化学变化过程
|
|
| 2. 单选题 | |
|
NA为阿伏加德罗常数,下列说法正确的是( )
A . 100mL12Lmol•L﹣1浓盐酸与足量MnO2共热,转移的电子数为0.6NA
B . 1mol•L﹣1的NaClO溶液中含有ClO﹣的数目为小于NA
C . 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
D . O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA
|
|
| 3. 单选题 | |
|
相对分子质量都为88的饱和一元醇与饱和一元羧酸发生酯化反应,最多可得到的酯有(不考虑立体异构)( )
A . 18种
B . 16种
C . 14种
D . 12种
|
|
| 4. 单选题 | |
|
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700﹣900℃温度时,O2﹣可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( )
A . 电池内的由O2﹣电极乙移向电极甲
B . 电池的总反应为:N2H4+2O2═2NO+2H2O
C . 当甲电极上有1molN2H4消耗时,乙电极上有1molO2被氧化
D . 电池外电路的电子由电极乙移向电极甲
|
|
| 5. 单选题 | |
|
已知X、Y、Z、W都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,W的族序数比X的族序数大1,则下列说法错误的是( )
A . Y和Z以质量比7:16组成的共价化合物有两种
B . X和Y、X和Z组成的常见化合物,稳定性前者大于后者
C . X、Z、W简单离子的半径由大到小的顺序为:Z>W>X
D . X、Y、Z可以组成一种离子化合物,其中X、Y、Z元素原子个数比为4:2:3
|
|
| 6. 单选题 | |
|
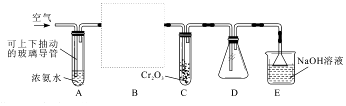
图是制溴苯的简易实验装置,下列说法错误的是( )
A . 制备溴苯的反应属于取代反应
B . 烧瓶中反应发生后,有白雾产生,继而充满红棕色气体
C . 实验加入试剂的顺序可以是:苯、液溴、铁粉
D . 为了增强验证HBr的实验效果,可将锥形瓶中的导管插入溶液中
|
|
| 7. 单选题 | |
|
常温下,各取1mL,pH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
A . H2A的酸性比H2B弱
B . C点溶液的导电性比a、b点溶液的导电性都强
C . 若0.1mol•L﹣1NaHA溶液的pH=4,离子浓度大小为c(Na+)>c(HA﹣)>c(A2﹣)>c(H2A)>c(H+)>c(OH﹣)
D . N2B的水溶液中,离子浓度大小为c(Na+)>c(B2﹣)>c(OH﹣)>c(H+)
|
|
| 8. 综合题 | |
|
工业上用氨催化氧化制硝酸
|
|
| 9. 综合题 | |||||||||||||
|
钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
|
|||||||||||||
| 10. 综合题 | |||||||||||||||||||
|
煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等,回答下列问题:
|
|||||||||||||||||||
高中化学 试卷推荐
- 江苏省高邮临泽中学2020-2021学年高一下学期化学第一次月考试卷
- 山西省怀仁市2020-2021学年高二上学期化学期中考试试卷
- 云南省玉溪市2021-2022学年高三上学期化学第一次月考试卷
- 吉林省松原市六校2021-2022学年度高一上学期月考联考试卷化学试卷
- 江苏省徐州市2020-2021学年高二上学期化学期中考试试卷(选修)
- 西藏拉萨市2021年高考化学二模试卷
- 备考2021年高考化学二轮专题 第1讲 物质的组成、分类及化学用语
- 江西省宜春市2020-2021学年高二年级上学期期末质量监测化学试题
- 福建省龙岩市2021年高考化学三模试卷
- 2022年高考理综化学真题试卷(全国乙卷)
- 吉林省洮南市一高2020-2021学年高一下学期化学6月月考试卷
- 四川省成都市南开为明学校2020-2021学年高三上学期化学9月月考试卷
最近更新