广西北海市2017-2018学年高三理综-化学一模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | ||||||||||||||||
|
以下说法错误的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 2. 单选题 | |
|
下列有关化学物质的叙述错误的是( )
A . 水可以用来分离甘油和乙醇
B . 果糖和葡萄糖互为同分异构体
C . 甲烷、甲醇、甲苯、甲酸均可发生取代反应
D . 植物油可经催化加氢转化为脂肪
|
|
| 3. 单选题 | |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A . 60gCH3COOH与乙醇发生酯化反应,充分反应后断裂C-O键数为NA
B . 0.2molHD与0.1mol 18O2所含中子数均为0.2NA
C . 1L0.5mo/L(NH4)2SO4溶液中氮原子数为NA
D . 2.24L (标准状况) CHCl3 所含共价键数为0.4NA
|
|
| 4. 单选题 | |||||||||||||||||||||
|
下列实验操作、现象与结论均正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子能形成最轻的气体单质;Y原子的最外层电子数是次外层的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
A . 五种元素的原子半径从大到的顺序是: M>W>Z>Y>X
B . X、Z两元表能形成原子个数比(X:Z)为3:1的化合物
C . 化合物YW2、ZW2都是酸性氧化物
D . 用M单质作阳极,石墨作阴极,电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
|
|
| 6. 单选题 | |
|
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时。电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极。碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图所示,其总反应式为H2+2NiOOH
 2Ni(OH)2以下说法正确的是( ) 2Ni(OH)2以下说法正确的是( )
A . 混合动力车上坡或加速时,乙电极为负极
B . 混合动力车在刹车或下坡时,乙电极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C . 混合动力车上坡或加速时,电解质溶液中的OH-向乙电极周围移动
D . 混合动力车上坡或加速时,乙电极周围溶液的pH减小
|
|
| 7. 单选题 | |
|
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示。下列说法错误的是( )
A . c点所得溶液中:c(A2-)=c(HA-)
B . b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C . A2-水解平街常数Kh(A2-)=10-7.19
D . a点所得溶液中,V0=10mL
|
|
| 8. 实验探究题 | |||||||||||||||||||||||||||||||
|
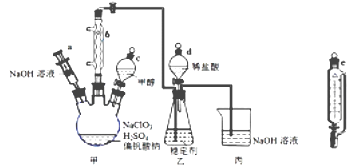
二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2 , 实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空:
|
|||||||||||||||||||||||||||||||
| 9. 实验探究题 | ||||||||||||||||
|
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。 磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
【方法一】 将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。 【方法二】 将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。 【方法三】 以铁红、锂辉石LiAl (SiO3)2 (含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
已知: 2LiAl (SiO3) 2+ H2SO4(浓)=Li2SO4+ Al2O3·4SiO2·H2O↓
|
||||||||||||||||
| 10. 综合题 | |
|
钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
|
|
- 2016-2017学年贵州省遵义市高三上学期期中化学试卷
- 2015-2016学年山东省潍坊市高三上学期期末化学试卷
- 甘肃省武威市第十八中学2018-2019学年高二上学期化学期末考试试卷
- 2016-2017学年湖北省黄冈市蕲春县高一下学期期中化学试卷
- 北京市顺义区2015-2016学年高三上学期化学期末统考考试试卷
- 人教(新课标)高中化学一轮复习:专题7常见的有机化合物
- 广东省汕头市2017-2018学年高三理综-化学第一次模拟考试试卷
- 2015-2016学年江西省赣州市于都三中高二下学期第一次月考化学试卷
- 人教版化学高二选修2第二单元课题2海水的综合利用同步练习
- 湖北省孝感市八校教学联盟2017-2018学年高一下学期化学期末考试试卷
- 2017年高考化学备考复习专题十二:重要的有机化合物
- 专题12:氮族元素及其化合物