课题2 酸和碱的中和反应 知识点题库
第一步:验证废水酸性.往废水中滴加石蕊试液,石蕊变,说明废水呈酸性.
第二步:处理废水.该小组同学设计了以下两个方案.
方案一:用熟石灰处理废水,其反应的化学方程式为.
方案二:用BaCl2处理废水,观察到废水中出现.
经过分析,同学们认为方案二没有达到处理废水的目的,因为处理后的废水中含有较多的.
【提出问题】废液中含有什么物质?
【交流表达】
-
(1) 小明通过观察,认为废液中一定含有硫酸铜.他观察到的现象是.
-
(2) 小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是:
.
-
(3) 【作出猜想】小华认为废液中还可能含有硫酸.
【实验验证】
小华测得废液的pH小于7,证明废液中含有硫酸.用pH试纸测定溶液pH的方法:.
-
(4) 小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论.小明的实验现象是.通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸.
-
(5) 【拓展应用】
①若将废液中的溶质全部转化为硫酸亚铁,应向废液中加入过量的.写出该反应过程中的一个化学方程式.
②反应完全后,过滤,滤渣中物质为,滤液中溶质为硫酸亚铁.
 B . 溶液pH:
B . 溶液pH:  C . 金属活动性顺序:
C . 金属活动性顺序:  D . 硫元素质量分数:
D . 硫元素质量分数: 
 B .
B .  C .
C .  D .
D . 
 B . 测溶液的pH
B . 测溶液的pH  C . 稀释浓硫酸
C . 稀释浓硫酸  D . 蒸发食盐水
D . 蒸发食盐水 

图1
实验 | a中试剂 | b中试剂 | c中试剂 |
I | 5%H2O2溶液 | MnO2 | 80 ℃热水 |
II | 石蕊溶液 | HCl气体 | NaOH溶液 |
已知:HCl气体极易溶解于水。白磷的着火点为40 ℃。
-
(1) 实验I中,若在c中长导管口处放置一块白磷,当打开止水夹后,可观察到白磷燃烧,通过此实验能证明燃烧的条件是。 若要证明燃烧的另一条件,在对比实验中,需将c中盛放的试剂改为。
-
(2) 实验II能证明NaOH与HCl发生了反应。实验过程中,打开止水夹d后,可观察到的现象为。
-
(3) 若按图2所示连接装置,进行实验II,则会观察到c中长导管口有气泡产生,原因是。


请根据小明的操作和相关现象分析,下列描述错误的是( )
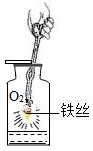 B . 酸碱中和
B . 酸碱中和 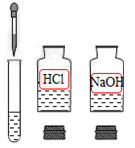 C . 检验CO2是否集满
C . 检验CO2是否集满 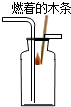 D . 过滤
D . 过滤 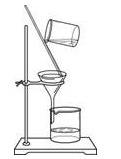
 用等质量、等质量分数的过氧化氢溶液在有无催化剂条件下制氧气
B .
用等质量、等质量分数的过氧化氢溶液在有无催化剂条件下制氧气
B .  向 pH=3 的溶液中加水
C .
向 pH=3 的溶液中加水
C .  向一定质量的硫酸铜溶液中逐滴加入氢氧化钠溶液
D .
向一定质量的硫酸铜溶液中逐滴加入氢氧化钠溶液
D .  向相同质量和相同质量分数的稀硫酸中,分别加入过量的镁粉和铝粉
向相同质量和相同质量分数的稀硫酸中,分别加入过量的镁粉和铝粉

-
(1) 该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。
-
(2) 电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。
-
(3) “沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。
-
(4) 磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。
-
(5) 研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。
溶液的pH
6.0
6.5
7.0
7.5
8.0
9.0
产物颜色
黄褐色
黄褐色
较黑
很黑
很黑
灰黑色
产率(%)
43.9
50.6
86.2
93.0
92.3
91.6
-
(1) 为了维持生命和健康,必须从食品中摄取六大类营养物质。人类食物所供给的总能量主要来自;
-
(2) 用酚醛塑料制成的把手属于(填“热塑”或“热固”)性塑料;
-
(3) 使用硬水会给生活带来许多麻烦,如(写一点);
-
(4) 饮用酸碱性太大的水不利于人体健康。可用 测定水的酸碱度;
-
(5) 在采摘园里闻到果香味,说明分子有的性质;
-
(6) 过氧化氢和水的化学性质不同的原因是;
-
(7) 火碱溶液和氨水都能使用石蕊溶液变蓝的原因是。
|
组别 |
第一组 |
第二组 |
|
实验示意图 |
| |
-
(1) 第一组实验中发生反应的化学方程式为,其中酚酞溶液的作用是。
-
(2) 第二组实验中观察到的实验现象是。
-
(3) 实验完毕后,同学们在整理仪器时,将上述实验后的废液倒入同一个洁净的废液缸中,发现混合后的废液显红色,于是引起了他们的探究兴趣。
(提出问题)混合后废液中的溶质有哪些?
(査阅资料)Na2CO3溶液呈碱性。
(做出猜想)猜想I:NaCl、NaOH、Ca(OH)2
猜想II:NaCl、NaOH、Na2CO3
猜想III:NaCl、NaOH。
(实验探究)
小林为了验证混合后废液中的溶质成分,取混合后的废液于试管中,向其中滴加少量的稀盐酸,观察到无明显现象。由此得出结论:猜想II不成立。小华认为小林的结论不严密,因为。小华另取少量混合后的废液于试管中,向其中滴加适量的,观察到有白色沉淀产生,证明猜想II成立。
-
(4) (反思交流)在确定发生反应后所得溶液中的溶质成分时,除了考虑生成物外,还要考虑。

-
(1) “西气东输”工程利于国家能源和产业结构调整,极大改善了沿海居民生活质量。
①CH4完全燃烧的化学方程式是,该过程(填“释放”或“吸收”)能量。
②天然气的使用可有效减少酸雨形成。如煤的燃烧产生、NO2等能形成酸雨。
-
(2) 工业上以CH4为原料生产H2 , 制取原理如图所示:

①“转化炉”中发生的反应是:
 , 其中X的化学式。
, 其中X的化学式。②“变换塔”中发生的反应是:
 , 其中生成的CO2在下一个流程的洗涤塔中进行化学反应。
, 其中生成的CO2在下一个流程的洗涤塔中进行化学反应。③“洗涤塔”中发生的反应是:(写化学方程式);气体从塔底通入,水从塔顶喷淋,这样操作的优点是。
-
(3) 我国是世界上首个成功试采海域可燃冰的国家。可燃冰是CH4被H2O分子形成的笼包裹,在海底低温和高压作用下形成的结晶物质。
①可燃冰样品常存放于液氮储存罐中,其原因是。
②可燃冰有多种结构,某H型可燃冰的化学式为
 , 分析其结构发现:平均每46个水分子构成8个笼(其中每个笼可容纳1个CH4分子或1个H2O分子),每8个笼中有6个容纳CH4分子,2个笼填充H2O分子,CH4分子与水分子个数比(填最小整数比)。
, 分析其结构发现:平均每46个水分子构成8个笼(其中每个笼可容纳1个CH4分子或1个H2O分子),每8个笼中有6个容纳CH4分子,2个笼填充H2O分子,CH4分子与水分子个数比(填最小整数比)。





