课题2 酸和碱的中和反应 知识点题库
下列各组物质能在pH=1的无色溶液中大量共存的是()
A . K2SO4 、Ba(OH)2 、KCl
B . Ca(NO3)2 、NaCl 、KNO3
C . MgSO4 、NaNO3 、CuSO4
D . Na2CO3 、KNO3 、NH4Cl
逻辑推理是化学学习常用的思维方法。下列观点正确的是
A . 在同一化合物中,金属元素显正价,所以非金属元素一定显负价
B . 酸的溶液pH值小于7,碱的溶液pH大于7,所以盐的溶液pH一定等于7
C . 氧化物含有两种元素,所以氧化物中一定有一种元素不是氧元素
D . 酸碱作用生成盐和水,所以生成盐和水的反应一定是中和反应
测定人体内体液的pH可以帮助我们了解身体状况.如图是明明同学体检报告单截图,看图后回答问题.
项目 | 检测值 | 正常pH范围 |
血浆 | 7.41 | 7.35~7.45 |
胃液 | 0.8↓ | 0.9~1.5 |
胆汁 | 7.21 | 7.1~7.3 |
胰液 | 7.8 | 7.5~8.0 |
(1)该同学哪项指标出现异常 .
(2)医生让明明服用一种主要成分为氢氧化铝的药物,请写出该反应的化学方程式 .
(3)明明服用的药物,可用厨房中的一种物质代替,这种物质是 .
某造纸厂的废水在排放前经测定显碱性.为了达标排放,该厂应将废水( )
A . 做pH增大处理
B . 做pH减小处理
C . 直接排放
D . 加碱处理
下列说法不正确的是( )
A . 等质量的CO和CO2 , CO和CO2中氧元素的质量比为11:14
B . 将溶质质量分数为98%的浓硫酸稀释为49%的硫酸,加水的体积与所取浓硫酸的体积一定相等
C . 等质量的NaHCO3和MgCO3分别与足量稀盐酸充分反应,生成CO2的质量相等
D . 等质量的质量分数均为4%氢氧化钠溶液与稀硫酸充分反应后,所得溶液显碱性
甲、乙、丙三位同学为一家化工厂的污水设计排污方案,请你就他们的探究过程回答有关问题.
Ⅰ.首先用pH试纸检测污水的酸碱性.三位同学分别进行如下实验:
甲:取pH试纸于玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
乙:取pH试纸于玻璃片上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
丙:取pH试纸直接浸入待测液中,测得pH<7.
-
(1) 以上三位同学中操作规范的是,污水显性.
Ⅱ.利用中和反应原理测定污水中污染物(设为盐酸)的质量分数.
甲、乙两同学设计的方案如图甲、乙所示:

-
(2) 甲同学取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞变红色,于是得出“两种物质已恰好中和”的结论.你认为他的结论是否正确?,理由是.
-
(3) 乙同学当观察到现象时即恰好完全反应,若此时消耗NaOH溶液2g,则污水中HCl的质量分数为.
-
(4) 实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且要用玻璃棒不断搅拌,目的是
丙同学利用连线在传感器上的计算机随机绘制出了如图丙所示的溶液的pH随所加的NaOH溶液体积变化的曲线.
-
(5) 从曲线上可知污水的pH=,M点表示的含义是.
-
(6) 除去污水中的盐酸,你建议选用的原料是 .A . NaOH; B . Ca(OH)2; C . CuO; D . Fe.
下列实验操作可能产生的后果:
-
(1) 铁丝在氧气里燃烧时,集气瓶中没有加入少量水或铺一层细砂;
-
(2) 在实验室加热高锰酸钾制取氧气,实验完毕后,先熄灭酒精灯,再把导气管移出水面.
-
(3) 测食醋的pH时,先用水润湿pH试纸,测得结果.(填偏大或偏小)
酸、碱、盐都是重要的化合物,请回答下列有关问题.
-
(1) 家中的暖水瓶使用一段时间后,有一层厚厚的水垢,下列最适宜用来除去暖水瓶中水垢的是 .A . 碳酸 B . 小苏打 C . 食醋 D . 浓硫酸
-
(2) 浓硫酸和浓盐酸敞口放置一段时间,溶液的溶质质量分数都会减小,请分析原因.
-
(3) 酸还可用于金属除锈,写出用稀硫酸出铁锈的化学方程式.
-
(4) 用盐酸按如图进行中和反应的实验,其反应的化学方程式为,能够说明盐酸与氢氧化钠发生了化学反应的实现现象是.
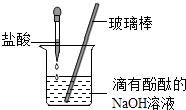
-
(5) 现有部分变质的氢氧化钠样品18.6g与146g溶质质量分数为10%的盐酸溶液恰好完全反应生成CO24.4g.计算样品中NaOH的质量分数.
下列常见物质水溶液的pH<7的是( )
A . 食盐
B . 食醋
C . 纯碱
D . 烧碱
下列实验操作正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
下面实验操作正确的是( )
A . 稀释浓硫酸  B . 称量固体NaOH
B . 称量固体NaOH  C . 量度液体体积
C . 量度液体体积  D . 测溶液的酸碱度
D . 测溶液的酸碱度 
 B . 称量固体NaOH
B . 称量固体NaOH  C . 量度液体体积
C . 量度液体体积  D . 测溶液的酸碱度
D . 测溶液的酸碱度 
下列说法中正确的是( )
A . 通常把pH<7的降雨称为酸雨
B . 不同元素最本质的区别是质子数不同
C . 露置于空气中的澄清石灰水,其成分不会发生变化
D . 浓硫酸露置于空气中、溶质的质量分数会变大
实验小组用
pH 传感器探究稀盐酸和氢氧化钠溶液的反应。实验操作和测定结果如图所示:

-
(1) 盐酸和氢氧化钠反应的化学方程式为。
-
(2) 该实验中,甲溶液是。
-
(3) 能说明盐酸与氢氧化钠发生化学反应的依据是。
-
(4) 60 s 时,烧瓶内溶液中的溶质是。
规范的操作是实验成功的保证。下列实验操作正确的是( )
A . CO2验满  B . 检查装置的气密性
B . 检查装置的气密性  C . 滴加液体
C . 滴加液体  D . 测溶液pH
D . 测溶液pH 
 B . 检查装置的气密性
B . 检查装置的气密性  C . 滴加液体
C . 滴加液体  D . 测溶液pH
D . 测溶液pH 
运用分类、类比等方法学习化学,可以起到事半功倍的作用。
-
(1) 下列化学实验中都用到了玻璃棒,根据实验中所用玻璃棒的作用,应将 C 中物质归为组(填 A 或 B),理由是。
A组
B组
C
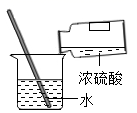
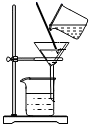


蒸发
浓硫酸稀释
过滤
测定溶液的 pH
物质的溶解
-
(2) 像氯化钠这样由(填符号)通过静电作用形成的化合物叫离子化合物。而氯化氢的形成过程则不同,氢原子趋向于得一个电子,氯原子也趋向于得一个电子,双方各拿出一个电子组成共用电子对,为两个原子所共用。像氯化氢这样以共用电子 对形成分子的化合物叫共价化合物。下列属于离子化合物的是(填字母)。
A、CO B、 H2O C、 ZnS
化学与人类的生活关系密切。
-
(1) 向 2mL 白葡萄酒中滴加几滴紫色石蕊溶液,溶液呈红色,其溶液的 pH 7(填“>”、 “<”或“=”)。
-
(2) 食品安全日益受到人们关注。下列食品不能食用的是(填序号)。
A 甲醛浸泡的海产品 B 霉变的大米、花生
C 食盐腌制的咸鸭蛋 D 牛奶发酵制得的酸奶
-
(3) 水果和蔬菜富含的营养素是,该营养素可以起调节新陈代谢等作用。为了防止骨质疏松,人体每日必须摄入足够量的元素。
下表是一些食物的pH值,对于胃酸过多的病人,可多食用的是( )
| A.泡菜 | B.葡萄 | C.番茄 | D.鸡蛋清 | |
| pH值 | 3.2-3.6 | 3.5-4.5 | 4.0-4.4 | 7.6-8.0 |
A . A
B . B
C . C
D . D
某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
下列有关说法或做法正确的是( )
A . 蚊虫叮咬后涂抹氢氧化钠溶液止痒
B . 用钢丝球擦拭铝制品表面使之光亮
C . 室内起火,立即打开门窗大声呼救
D . 堆放杂物的纸箱着火,用水浇灭
人的生活离不开化学,请用化学知识回答以下问题:
-
(1) 多步行,骑单车出行,能有效减少CO2、SO2、CO等气体的排放,这些气体中能引起温室效应的是,会造成酸雨的是。
-
(2) 化石燃料包括煤、和天然气,它们属于(填“可再生”或“不可再生”)能源,其中天然气的主要成分为。
-
(3) 使燃料充分燃烧对于节约能源非常重要。燃料充分燃烧通常考虑两点:一是燃烧时要有足够的空气;二是。新能源的利用可以部分解决化石能源面临耗尽的问题,目前人们正在开发和利用的新能源有(填一种)。
最近更新



