第2节 化学反应中的质量关系 知识点题库
化学中常常出现“1+1≠2”的有趣现象,但也有例外,下列符合“1+1≠2”的事实是( )
A . 20℃,1L水与1L酒精混合后的体积等于2L
B . 20℃,1g硫粉在1g氧气中完全燃烧后生成2g二氧化硫
C . 20℃,1g镁和1g稀硫酸充分反应后所得的溶液质量为2g
D . 20℃,1g硝酸钾饱和溶液中加入1g硝酸钾固体能得到2g硝酸钾溶液
用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是( )

A . 甲的化学式为CH2
B . 反应中甲、乙、丙的分子个数比为2:1:1
C . 甲、乙、丙都是氧化物
D . 乙中氢元素质量分数最低
生活中的自来水通常用氯气(Cl2)进行杀菌消毒处理,发生反应的化学方程式是Cl2+ H2O=X+HClO。则X的化学式为( )
A . H2
B . ClH
C . HCl
D . ClO2
某化学兴趣小组同学们与老师一起探究铝的化学性质时发现, 铝还能与氢氧化钠溶液反应,其反应的化学方程式为:2Al+ 2NaOH+ 2H2O=2NaAlO2 +3H2↑。现取某氢氧化钠溶液样品50g例入烧杯中,再向其中放入足量打磨好的铝片,生成气体质量与加入铝片质量的变化关系如图所示。

试回答下列问题:
-
(1) 反应完成后生成氢气的质量为g。
-
(2) 求原氢氧化钠溶液中氢氧化钠的质量分数为多少。(请写出计算过程)
我国早在西汉时期,在《淮南万毕术》一书中就写到“曾青得铁则化为铜”,这是湿法冶金的先驱。反应原理为:Fe+CuSO4=Cu+FeSO4 , 下列说法正确的是( )
A . 该反应无明显现象
B . 该反应能证明铜的金属活动性比铁强
C . 该反应属于置换反应
D . 该反应前后溶液质量增大
取一定量的氧化铁和氧化亚铁的混合物,加入100 g 9.8%的稀硫酸,恰好完全反应生成盐和水。则原固体混合物中氧元素的质量是( )
A . 9.8 g
B . 3.2 g
C . 1.6g
D . 19.6 g
某物质在氧气中燃烧只生成CO2和H2O。下列说法正确的是( )
A . 该物质一定是混合物
B . 该物质一定含有碳、氢、氧三种元素
C . 该物质是由CO2和H2O组成的
D . 该物质一定含有碳元素和氢元素,可能含氧元素
回答下列有关的实验问题:

-
(1) 实验一中,打开止水夹进入瓶中的水不足五分之一,其原因是;
-
(2) 实验二中,观察到的现象是;
-
(3) 实验三电解水过程中,正、负两极产生气体的体积比约为;
-
(4) 实验四中发生的反应用化学方程式表示为:Na2CO3+2HCl=2NaCl+H2O+CO2↑。若用其验证质量守恒定律不能得到正确结论,在不更换药品的情况下改进,使其遵守质量守恒定律,你的改进方法是。
现有Na2SO4、NaOH、NaCl、Na2CO3四种物质的溶液,分别与其它四种不同物质中的一种反应,都有同一种化合物X生成,则化合物X的化学式可能为下列物质中的()
A .  B . AgCl
C .
B . AgCl
C . 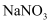 D .
D . 
 B . AgCl
C .
B . AgCl
C . 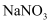 D .
D . 
甲、乙、丙、丁四种物质,存在关系:甲+乙→丙+丁。下列说法正确的是( )
A . 若甲为单质,则该反应一定是置换反应
B . 若该反应为复分解反应,则生成物中一定有水
C . 甲、乙、丙、丁可分属四种不同类别的化合物
D . 若甲为20g、乙为15g,则反应生成丙和丁的质量总和一定等于35g
铜锈的主要成分是碱式碳酸铜〔化学式为Cu2(OH)2CO3〕。为探究铜锈加热分解的产物,取一定量铜锈在试管中进行加热,能观察到生成黑色固体,并产生能使澄清石灰水变浑浊的气体。思考并回答:
-
(1) 产生的气体中肯定含有。
-
(2) 对生成的黑色固体物质的猜想是:①可能是木炭;②可能是四氧化三铁;③可能是一种叫氧化铜(CuO)的黑色粉末。你认为上述猜想缺乏依据的是(填编号),理由是。
逻辑推理是一种重要的化学思维方法,以下推理合理的是()
A . 因为离子是带电的原子或原子团,所以带电的粒子一定就是离子
B . 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有C和H
C . 因为单质中只含一种元素,所以只含一种元素的物质一定是单质
D . 因为金属和酸反应能生成气体,所以和酸反应生成气体的物质一定是金属
将12.5g的大理石(杂质不参加反应,也不溶于水)放到盛有100g稀盐酸中的烧杯中,恰好完全反应。反应后烧杯内物质的总质量为108.1g,求:
-
(1) 生成二氧化碳g。
-
(2) 所用100g稀盐酸中溶质的质量分数。
小明在实验室中为完成制取氧气的实验,他称取一定质量的氯酸钾和二氧化锰放入大试管中加热,反应前后质量变化如下表:
|
实验前 |
实验后 |
|
|
氯酸钾/g |
二氧化锰/g |
剩余的固体混合物/g |
|
15g |
5g |
15.2g |
请计算:
-
(1) 生成氧气的质量是g。
-
(2) 求参加反应的氯酸钾的质量(写出计算过程)。
在空气中高温煅烧黄铁矿的主要反应为  ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )
A . SO2分子中含有氧分子
B . SO2是一种空气污染物
C . X的化学式是Fe2O3
D . FeS2中铁元素和硫元素质量比为7:8
将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:下列判断正确的是( )
| 物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前的质量/g | 4.6 | 8.0 | 0 | 0 | 0 |
| 反应后的质量/g | 0 | 0 | 5.4 | 4.4 | a |
A . 表中a的值为2.6
B . X一定是该反应的催化剂
C . X可能含有氢元素
D . 若起始时氧气的质量是9.6g,则无X生成
某学生将锌粒放入CuSO4溶液中,发现锌粒表面有红色物质析出,同时还有少量无色无味气泡产生。对于产生气泡的“异常现象”,下列猜想无科学道理的是( )
A . 产生的气体可能是H2
B . CuSO4溶液的pH可能小于7
C . CuSO4溶液可能显酸性
D . 产生的气体可能是CO2
浓硝酸要放在棕色试剂瓶内避光保仔,原因是浓硝酸见光会分解,生成一种有刺激性气味的气体,该气体可能是( )
A . 氮气
B . 二氧化硫
C . 二氧化氮
D . 氯化氢
取Na2CO3和NaCl的混合物10g加入50g水中形成溶液,再向其中加入CaCl2溶液,反应时CaCl2溶液与产生的沉淀的质量关系如图所示。

-
(1) 恰好完全反应时生成沉淀g。
-
(2) 请计算原混合物中Na2CO3的质量。
-
(3) 恰好反应完时所得溶液中溶质的质量分数。
在化学实验中,所谓物质的检验就是根据物质的特性来选择适当的试剂和实验操作方法,然后根据反应中观察到不同实验现象的加以判定。请根据图示回答下列问题。

-
(1) 甲试管中发生反应化学方程式为。
-
(2) 乙实验(填“能”或“不能”)用来检验葡萄糖。
-
(3) 丙试管中先装有2 mL的氯化钠溶液,再向其中滴入几滴硝酸银溶液和稀硝酸,所观察实验现象为,反应化学方程式为。
-
(4) 丁实验B烧杯中发生:2KMnO4+5SO2+2H2O=K2SO4+2+ 2H2SO4。
最近更新



