第二节 离子反应 知识点题库
下列各组物质的分类都正确的是(括号里的是类别)( )
A . 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B . 液氨(氢化物)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C . HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D . NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
下列离子方程式正确的是( )
A . 硫酸镁溶液跟氢氧化钡溶液反应:SO42﹣+Ba2+=BaSO4↓
B . 硫酸和氢氧化铜溶液混合:H++OH-=H2O
C . 澄清石灰水中加入盐酸 Ca(OH)2+2H+=Ca2++2H2O
D . 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag
能符合题意表示下列化学反应的离子方程式是( )
A . 铜片插入硝酸银溶液中Cu+Ag+ =Cu2++Ag
B . 澄清石灰水滴入稀盐酸中Ca(OH)2+2H+ =Ca2++2H2O
C . 稀H2SO4与铁粉反应:2Fe+6H+ =2Fe3++3H2↑
D . 碳酸钠溶液与硝酸钙溶液混合CO32-+Ca2+=CaCO3↓
下列离子方程式书写正确的是( )
A . 已知氧化性Fe3+>I2 , 则FeCl2 溶液中滴加碘水: 2Fe2++I2=2Fe3++2I-
B . 向碳酸氢铵溶液中滴加过量热的氢氧化钠溶液NH4++HCO3-+2OH-  NH3↑+CO32-+2H2O
C . 向盐酸中滴加氨水: H++OH-= H2O
D . 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
NH3↑+CO32-+2H2O
C . 向盐酸中滴加氨水: H++OH-= H2O
D . 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
 NH3↑+CO32-+2H2O
C . 向盐酸中滴加氨水: H++OH-= H2O
D . 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
NH3↑+CO32-+2H2O
C . 向盐酸中滴加氨水: H++OH-= H2O
D . 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
下列方程式书写错误的是( )
A . HCO3-的电离方程式:HCO3-+H2O  H3O++CO32-
B . Cu2+的水解方程式:Cu2++2H2O
H3O++CO32-
B . Cu2+的水解方程式:Cu2++2H2O  Cu(OH)2+2H+
C . NH4+的水解方程式:NH4++2H2O
Cu(OH)2+2H+
C . NH4+的水解方程式:NH4++2H2O  NH3·H2O+H3O+
D . CaCO3的电离方程式:CaCO3
NH3·H2O+H3O+
D . CaCO3的电离方程式:CaCO3  Ca2++CO32-
Ca2++CO32-
下列属于非电解质的是()
A . 金属铜
B . 浓硫酸
C . 氨气
D . 水
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A . 加入AgNO3溶液,生成白色沉淀,加稀盐酸后沉淀不溶解,可确定有Cl-存在
B . 通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C . 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解,可确定有SO42-存在
D . 加入稀盐酸,生成的气体能使品红溶液褪色,可确定有SO32-存在
下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 磷酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氨水 | 盐酸 | 铜 |
| D | 胆矾 | 食盐水 | 氯化铜 | 石墨 |
A . A
B . B
C . C
D . D
水溶液呈酸性的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
下列物质熔融状态时不导电的是( )
A . MgF2
B . KCl
C . H2SO4
D . NaOH
下列说法正确的是( )
A . 水的电离方程式:H2O = H++ OH-
B . pH=7的溶液一定是中性溶液
C . 升高温度,水的电离程度增大
D . 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
在石墨材料性能提升的帮助下,锂离子电池的性能也得到了大幅提升,华为公司曾开发出石墨烯锂离子电池,其工作原理如图1所示,该锂离子电池正极铝钴膜主要含有 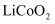 、
、 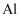 等,处理该正极废料的一种流程如图2所示:
等,处理该正极废料的一种流程如图2所示:
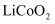 、
、 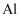 等,处理该正极废料的一种流程如图2所示:
等,处理该正极废料的一种流程如图2所示: 
请回答下列问题:
-
(1) “碱浸”时发生反应的离子方程式为。
-
(2) 滤渣的主要成分的化学式为。
-
(3) “酸溶”时
 的作用是,“酸溶”时温度不宜过高的原因是。盐酸可以代替
的作用是,“酸溶”时温度不宜过高的原因是。盐酸可以代替  和
和  的混合液,但工业上都不采用盐酸,其原因是。
的混合液,但工业上都不采用盐酸,其原因是。
-
(4) 用图1中锂离子电池作电源电解制备
 的装置如图3所示,d与锂离子电池的极相连(填“a”或“b”),电解池中发生的总反应离子方程式为。当锂离子电池中有
的装置如图3所示,d与锂离子电池的极相连(填“a”或“b”),电解池中发生的总反应离子方程式为。当锂离子电池中有 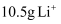 移向正极时,电解池中阴极区溶液质量的变化量为g。
移向正极时,电解池中阴极区溶液质量的变化量为g。
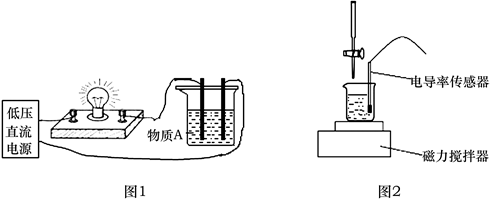
可用下列导电性实验装置(如图1、图2)来研究电解质的电离本质及反应机理。
-
(1) 图1中,若灯泡亮,广口瓶内的物质A可以是 (填序号)。
①氯化钠晶体 ②氢氧化钠溶液 ③蔗糖溶液 ④纯醋酸 ⑤硫酸铜溶液 ⑥氨水
-
(2) 图1中,若向烧杯中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮,下列符合条件的是______(填序号)。A . 盐酸中逐滴加入食盐溶液 B . 氢氧化钡溶液中逐滴滴入硫酸钠溶液 C . 石灰乳中滴加稀盐酸 D . 硫酸铜溶液中逐滴加入氢氧化钡溶液
-
(3) 图2中,通过电导率传感器可探究离子反应的实质。在相同温度下,测得10 mL 0.5 mol·L-1 K2SO4的电导率(填“>”“<”或“=”)5 mL 1mol·L-1 K2SO4的电导率。
下列离子方程式书写正确的是( )
A . 钠与水反应:Na+2H2O═2Na++2OH-+H2↑
B . 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C . 碳酸氢钠溶液和氢氧化钠溶液反应:HCO  +OH-=CO
+OH-=CO  +H2O
D . 碳酸钙与稀盐酸反应:CO
+H2O
D . 碳酸钙与稀盐酸反应:CO  +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
 +OH-=CO
+OH-=CO  +H2O
D . 碳酸钙与稀盐酸反应:CO
+H2O
D . 碳酸钙与稀盐酸反应:CO  +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
下列离子方程式书写正确的是( )
A . 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B . 碳酸钙与盐酸反应:CO  +2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO
+2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO  +H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO
+H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO  =BaSO4↓
=BaSO4↓
 +2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO
+2H+=CO2↑+H2O
C . 澄清石灰水中通入少量的二氧化碳:2OH-+CO2=CO  +H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO
+H2O
D . 硫酸钠和氯化钡溶液反应:Ba2++SO  =BaSO4↓
=BaSO4↓
五氟化锑( 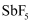 )是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为  ,含有少量CuO、PbO、
,含有少量CuO、PbO、  等杂质)为原料制备
等杂质)为原料制备 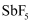 的工艺流程如图。
的工艺流程如图。
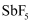 )是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为  ,含有少量CuO、PbO、
,含有少量CuO、PbO、  等杂质)为原料制备
等杂质)为原料制备 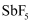 的工艺流程如图。
的工艺流程如图。
已知:I.CuS、PbS的Ksp分别为 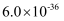 、
、 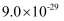
Ⅱ.  微溶于水、
微溶于水、  难溶于水,它们均为两性氧化物;SbOCl难溶于水。
难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
-
(1) 浸出时少量
 转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为
转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为  ,该反应的离子方程式为
,该反应的离子方程式为
-
(2) “除砷”时,
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为
-
(3)
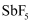 与
与 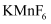 反应,首次实现了用化学方法制取F2 , 同时生成
反应,首次实现了用化学方法制取F2 , 同时生成 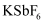 和
和  ,化学反应方程式为
,化学反应方程式为
-
(4) 已知

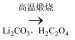 LiFePO4 , 写出该反应的化学方程式
LiFePO4 , 写出该反应的化学方程式
 和
和 在工业上用途广泛,某同学为探究
在工业上用途广泛,某同学为探究 、
、 的性质,设计如下装置进行实验。
的性质,设计如下装置进行实验。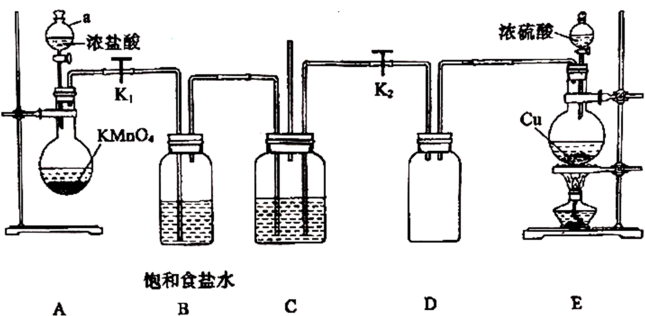
-
(1) 图中仪器a的名称,E中发生反应的化学方程式为。
-
(2) 若C中加入淀粉碘化钾溶液,关闭
 , 打开
, 打开 , 使A产生的气体进入C,则C中实验现象为。
, 使A产生的气体进入C,则C中实验现象为。
-
(3) 若C中加入品红溶液,打开
 、
、 , 使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为(用离子方程式表示)。
, 使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为(用离子方程式表示)。
-
(4) 若C中加入
 溶液,先打开
溶液,先打开 , 使E产生的气体进入C,观察到C中无明显现象,再打开
, 使E产生的气体进入C,观察到C中无明显现象,再打开 , 使A产生的气体进入C,观察到C中产生白色沉淀。则此白色沉淀为(填化学式)。
, 使A产生的气体进入C,观察到C中产生白色沉淀。则此白色沉淀为(填化学式)。
-
(5) 该同学设计的装置有一处明显的缺陷是。
某溶液由Na+、Mg2+、Ba2+、Fe3+、HCO 、SO
、SO 、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验:
、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验:
 、SO
、SO 、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验:
、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验: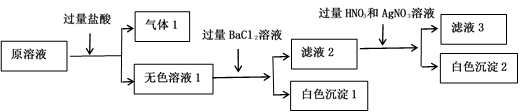
根据以上实验判断,下列推断不正确的是( )
A . 少量气体1通入澄清石灰水中,溶液变浑浊
B . 白色沉淀1中加稀硝酸,沉淀不溶解
C . 原溶液中一定存在Na+、Mg2+ , 可能存在Cl-
D . 滤液2中加入足量碳酸钠溶液会产生白色沉淀
实验室可用如下图装置(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。
 并验证其性质。
并验证其性质。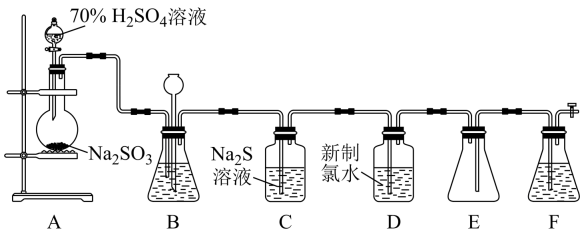
-
(1) 盛装
 仪器名称是(填代号)。
仪器名称是(填代号)。
-
(2) 装置B可以通过观察产生气泡的多少判断反应的快慢,最好盛装(填代号)。
A.蒸馏水 B.饱和NaHCO3溶液 C.饱和NaHSO3溶液 D.饱和NaOH溶液
-
(3) C装置可以验证
 具有性(选填"氧化性"、"还原性")。
具有性(选填"氧化性"、"还原性")。
-
(4) 装置D中发生反应的离子方程式为。
-
(5) 装置F中为溶液。
-
(6) 煤燃烧会产生含
 的废气,可以采用"钙基固硫法"解决。即将生石灰与含硫的煤混合后再燃烧,可以将生成的
的废气,可以采用"钙基固硫法"解决。即将生石灰与含硫的煤混合后再燃烧,可以将生成的 最终转化为
最终转化为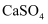 , 请写出该反应化学方程式为。
, 请写出该反应化学方程式为。
下列各组离子中,在酸性溶液中能大量共存的无色溶液( )
A .  、
、 、
、 、
、 B .
B .  、
、 、
、 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、 、
、
 、
、 、
、 、
、 B .
B .  、
、 、
、 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、 、
、
最近更新



