第二节 离子反应 知识点题库
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4、振荡、静置 | CCl4层呈橙色 |
③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
根据上述实验现象,判断以下结论中正确的是( )
 H2↑+Cl2↑+2OH﹣
C . 向氢氧化钡溶液中加入稀硫酸:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D . 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
H2↑+Cl2↑+2OH﹣
C . 向氢氧化钡溶液中加入稀硫酸:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D . 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O

-
(1) 研究现象a中的黄色溶液。
①用溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。
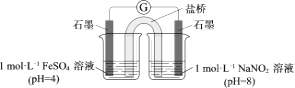
产生NO的电极反应式是。
实验Ⅱ的目的是。
-
(2) 研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是。
-
(3) 研究酸性条件下,溶液中Fe2+与NO2−、NO3−的反应。
序号
操作
现象
ⅰ
取1 mol·L−1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L−1FeSO4溶液
溶液立即变为棕色
ⅱ
取1 mol·L−1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L−1FeSO4溶液
无明显变化
ⅲ
分别取0.5 mL 1 mol·L−1的NaNO3溶液与1 mol·L−1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸
液体分为两层,稍后,在两层液体界面上出现棕色环
①ⅰ中溶液变为棕色的离子方程式是、。
②ⅲ中出现棕色的原因是。
实验结论:本实验条件下,溶液中NO2−、NO3−的氧化性与溶液的酸碱性等有关。
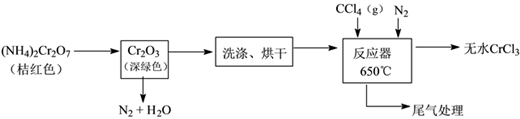
-
(1) 重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因,如何判断其已洗涤干净。
-
(2) 已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是。
-
(3) 用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4 , 并加热CCl4 , 温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4 , 继续通入氮气;⑥检查装置气密性。操作顺序为:⑥→③→。

-
(4) 已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2 , 因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2 , 生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为。
-
(5) 样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2 , 充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O
 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。已知:Cr2O
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。已知:Cr2O  +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。①该实验可选用的指示剂名称为。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是。
③样品中无水三氯化铬的质量分数为。
|
族 周期 |
ⅠA |
0 |
||||||
|
① |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
② |
② |
③ |
④ |
|||||
|
③ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||
-
(1) 第三周期中元素非金属性最强的元素的原子结构示意图是。
-
(2) ②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是(填化学式)。
-
(3) 用电子式表示⑨的氢化物的形成过程:。
-
(4) 下列可以判断⑤和⑥金属性强弱的是(填序号)。
a.单质的熔点⑤比⑥低
b.化合价⑤比⑥低
c.单质与水反应⑤比⑥剧烈
d.最高价氧化物的水化物的碱性⑤比⑥强
-
(5) 为验证ⅦA族部分元素非金属性的递变规律,设计下图装置进行实验,请回答:

①仪器A的名称是,A中发生的反应的离子方程式是。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)。
③为验证溴与碘非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到。该实验必须控制加入的⑨单质的量,否则得不出溴的非金属性比碘强。理由是。
④ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐(填“增大”或“减小”),得电子能力逐渐减弱。
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加BaCl2溶液,有白色沉淀生成,加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| D | 向某溶液加NaOH并微热,产生能使湿润红色石蕊试纸变蓝的无色气体 | 该溶液中一定含有NH4+ |
 的溶液中:
的溶液中:  、
、  、
、  、
、  B . 滴加石蕊试剂变红的溶液中:
B . 滴加石蕊试剂变红的溶液中:  、 Fe2+ 、
、 Fe2+ 、  、
、  C . 酸性溶液中: Fe3+ 、
C . 酸性溶液中: Fe3+ 、  、
、 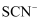 、
、  D . 澄清溶液中:
D . 澄清溶液中:  、
、 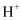 、
、  、
、 
-
(1) 1mol H2SO4中含有个硫原子,mol O。
-
(2) 写出下列物质在水溶液中的电离方程式
HCl:NaHSO4:
-
(3) 写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式
印刷电路板处理时铜与氯化铁溶液反应的离子方程式
-
(4) 配平下列方程式:
I-+IO3-+ H+—I2+H2O
NH4ClO4——N2↑+O2↑+HCl+H2O
-
(5) 用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O
HNO3的作用是,发生氧化反应,氧化产物是。
 H3O++S2-
B . HS-+H+=H2S
C . CO32-+2H2O
H3O++S2-
B . HS-+H+=H2S
C . CO32-+2H2O  H2CO3+2OH-
D . Fe3++3H2O
H2CO3+2OH-
D . Fe3++3H2O  Fe(OH)3+3H+
Fe(OH)3+3H+
 C . 向某溶液中加入硝酸银溶液,若产生白色沉淀,则该溶液中的阴离子一定是
C . 向某溶液中加入硝酸银溶液,若产生白色沉淀,则该溶液中的阴离子一定是  D . 向某溶液中加入过量的稀盐酸,无明显现象,再加入氯化钡溶液,若产生白色沉淀,则该溶液中的阴离子一定是
D . 向某溶液中加入过量的稀盐酸,无明显现象,再加入氯化钡溶液,若产生白色沉淀,则该溶液中的阴离子一定是 
-
(1) (填序号)属电解质的是;属非电解质的是;能导电的是。
-
(2) 写出⑦中溶质的电离方程式: 。

相关信息如下:
a.四氯化硅遇水极易反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | −70.0 | −107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
-
(1) 写出装置A中发生反应的离子方程式。
-
(2) 装置A上导管g的作用是;
-
(3) 装置F中的试剂是,作用是。
-
(4) 装置E中的h瓶需要冷却的理由是。
 的溶液中:
的溶液中: 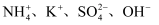 B . 无色透明的溶液中:
B . 无色透明的溶液中:  C . 含有大量
C . 含有大量 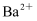 的溶液中:
的溶液中:  D . 使石蕊溶液呈红色的溶液中:
D . 使石蕊溶液呈红色的溶液中: 
 试纸变红的溶液中:
试纸变红的溶液中: 、
、 、
、 、
、 B . 在
B . 在 的溶液中:
的溶液中: 、
、 、
、 、
、 C .
C .  的溶液中:
的溶液中: 、
、 、
、 、
、 D . 由水电离产生的
D . 由水电离产生的 的溶液中:
的溶液中: 、
、 、
、 、
、
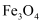 )颗粒中含有人体代谢生长必需的微量元素铁,不含其他有毒的金属元素,可以用于对比增强磁共振成像、免疫检测、组织修复、药物运输和细胞分离等方面。
)颗粒中含有人体代谢生长必需的微量元素铁,不含其他有毒的金属元素,可以用于对比增强磁共振成像、免疫检测、组织修复、药物运输和细胞分离等方面。【查阅资料】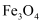 为黑色固体,硬度较大,有磁性,不溶于
为黑色固体,硬度较大,有磁性,不溶于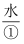 、碱和
、碱和 , 纳米
, 纳米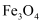 在潮湿的
在潮湿的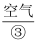 中容易被
中容易被 氧化,高温下被
氧化,高温下被 氧化成
氧化成 , 溶于
, 溶于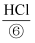 溶液中,生的
溶液中,生的 和
和 。向含有一定配比的
。向含有一定配比的 和
和 的混合盐溶液中,加入过量的碱液,如
的混合盐溶液中,加入过量的碱液,如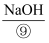 、
、 , 使其达到某个pH范围,在适当的温度和高速搅拌下发生反应合成纳米
, 使其达到某个pH范围,在适当的温度和高速搅拌下发生反应合成纳米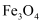 颗粒。
颗粒。
-
(1) 若将直径为80 nm的纳米
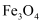 分散在水中,所形成的混合物属于(填“溶液”“胶体”或“浊液”),该混合物与⑦溶于水得到的混合物的本质区别是,可利用丁达尔效应进行区分,具体操作及现象为。
分散在水中,所形成的混合物属于(填“溶液”“胶体”或“浊液”),该混合物与⑦溶于水得到的混合物的本质区别是,可利用丁达尔效应进行区分,具体操作及现象为。
-
(2) 由⑦转化为⑧的反应属于(填“氧化还原反应”或“非氧化还原反应”)。
-
(3) ⑥在水中电离的电离方程式为;⑨在熔融状态下电离的电离方程式为。
-
(4) ⑧和⑨的水溶液反应的离子方程式为,该反应属于(填四大基本反应类型)。



