第四节 氨 硝酸 硫酸 知识点题库
①称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
②将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
③取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外),用酚酞作指示剂时,滴定到溶液颜色由色刚好变成色为止;
④某同学根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=.
⑤由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
-
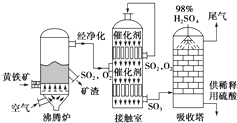
(1) 沸腾炉中发生的反应方程式为.
-
(2) 接触室中发生反应的化学方程式是、
-
(3) 依据工艺流程图判断下列说法正确的是(填字母).
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
-
(4) 吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2 . SO2吸收Br2的离子方程式是.
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Na2SO3 | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2 >Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
选项 | 实验操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多空的海绵状碳 | 浓硫酸具有吸水性和强氧化性 |
B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+ , 无K+ |
C | 向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
D | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的小 |
-
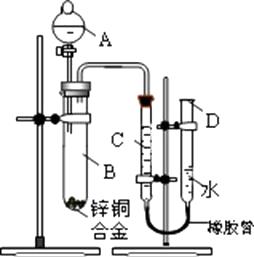
(1) 实验前,先将锌铜合金在稀硫酸中浸泡片刻,其目的是: ;
-
(2) 实验操作步骤有:①将药品和水装入各仪器中
②连接好装置后,检查气密性
③记录C的液面位置
④将B中剩余固体过滤,洗涤,干燥,称重
⑤待B中不再有气体产生并恢复至室温后,
记录C的液面位置
⑥由A向B滴加足量的稀硫酸
上述实验的正确操作顺序是 (填序号);记录C的液面位置时,除视线平视外,还应
-
(3) B中发生反应的化学方程式为 ;
-
(4) 若实验用锌铜合金的质量为a g,与稀硫酸充分反应后,
B中剩余固体的质量为bg,则锌的质量分数为 ;
-
(5) 实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将 (填“偏大”“偏小”或“不受影响”)。
 ,可以缓解能源不足的问题
C . 大力开发和应用太阳能有利于实现“低碳经济”
D . 工业上,不能采用电解
,可以缓解能源不足的问题
C . 大力开发和应用太阳能有利于实现“低碳经济”
D . 工业上,不能采用电解 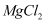 溶液的方法制取金属镁
溶液的方法制取金属镁
| 选项 | 表述I | 表述II |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | Cl2和SO2有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| C | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| D | SiO2有导电性 | SiO2可用于制光导纤维 |
![]()
下列判断错误的是( )

 B .
B . 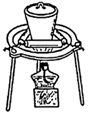 C .
C .  D .
D . | 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某溶液中先加入氯化钡溶液,再滴入盐酸 | 先产生白色沉淀,后白色沉淀不消失 | 该溶液中一定含有SO |
| B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g) |
| C | 在0.1mol·L-1K2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 | 先产生白色沉淀,后产生黑色沉淀 | Ksp(ZnS)>Ksp(CuS) |
| D | 室温下,用pH试纸分别测定浓度均为0.1mol·L-1的Na2SO3和NaHSO3两种溶液的pH | pH:Na2SO3>NaHSO3 | HSO |
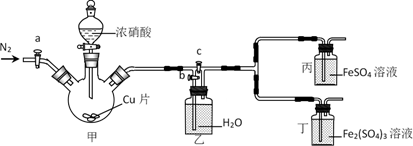
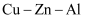 系催化剂的重要原料,常用的制取硝酸铜的方法有下列两种:①金属铜法:将浓硝酸加入反应器中,边搅拌边缓慢加入铜屑;②氧化铜法:将氧气通入铜屑与稀硝酸的反应体系中。下列说法错误的是( )
系催化剂的重要原料,常用的制取硝酸铜的方法有下列两种:①金属铜法:将浓硝酸加入反应器中,边搅拌边缓慢加入铜屑;②氧化铜法:将氧气通入铜屑与稀硝酸的反应体系中。下列说法错误的是( )
 B . 氧化铜法可以在铁制或铝制容器中进行
C . 两种方法中硝酸的利用率:②>①
D . 氧化铜法的总反应为
B . 氧化铜法可以在铁制或铝制容器中进行
C . 两种方法中硝酸的利用率:②>①
D . 氧化铜法的总反应为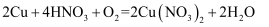

 N2O4(g) △H<0
N2O4(g) △H<0 结合H+能力比SO
结合H+能力比SO  的强
的强


