第四节 氨 硝酸 硫酸 知识点题库

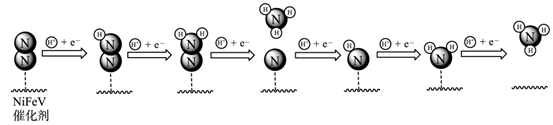
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
(1)从图中选择制取氮气的合适装置: (填编号)
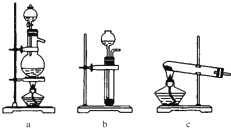
(2)氮气和氢气通过甲装置,甲装置的作用:① ② ③
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能说明反应发生的现象是 ,乙装置中的CCl4的作用是 .
(4)反应结束后锥形瓶内的溶液中含有的离子有:H+、OH﹣、 、 .
化学与生产、生活密切相关.下列与化学有关的事实及其相关化学方程式的书写都正确的是( )
选项 | 事实 | 化学方程式 |
A | 常温下,可用铝制容器盛放浓硝酸 | A l+3HNO3(浓)=Al(OH)3+3NO2↑ |
B | 可用生石灰做工业废气脱硫酸 | 2CaO+2SO2+O2=2CaSO4 |
C | 电解MgCl2溶液冶炼Mg | MgCl2 |
D | 侯德榜用饱和食盐水、氨水、CO2制备纯碱 | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
-
(1) 写出硝酸工业生产中相关的三个化学方程式:,,;
-
(2) 铝片与氢氧化钠溶液反应的离子方程式;
-
(3) 明矾溶液与过量氢氧化钡溶液反应的离子方程式;
-
(4) 在偏铝酸钠溶液中通入足量二氧化碳气体的离子方程式.
-
(1) 该反应的反应物和生成物中,属于氧化物的是.
-
(2) 木炭作(填“氧化剂”或“还原剂”),硫酸(填“被氧化”或“被还原”).
-
(3) 若消耗了1mol H2SO4 , 则生成 mol SO2 .
-
(1) 通常条件下,铜与稀盐酸不反应.但在如下两种情况下能发生:
①向稀盐酸中加入H2O2后,铜发生溶解.写出此反应的化学方程式:;
②如图,阳极的反应式,

总反应的化学方程式是
-
(2) 写出铜和浓硝酸反应的化学方程式:;
-
(3) 在一定体积的18mol/L的浓硫酸中加入过量的铜片,加热使之反应,化学方程式是:Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2(g)↑,若被还原的硫酸是0.9mol,则消耗此浓硫酸的实际体积100mL(填“大于”或“小于”).
CuSO4+2H2O+SO2(g)↑,若被还原的硫酸是0.9mol,则消耗此浓硫酸的实际体积100mL(填“大于”或“小于”).
-
(1) 若1 mol N2完全反应生成NH3可(填“吸收”或“放出”)热量kJ。
-
(2) 如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是。
-
(3) 一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
I.为了检验碳酸钠固体中是否混有碳酸氢钠,某同学设计了如下实验:
可选用的试剂:稀盐酸、稀CaCl2溶液、稀氢氧化钙溶液、氢氧化钠溶液、蒸馏水
|
实验操作 |
实验现象 |
|
取少量固体溶于水; |
得到澄清溶液; |
|
⑴向所得溶液中滴加足量; |
产生白色沉淀; |
|
⑵静置,; |
产生无色无味且能使澄清石灰水变浑浊的气体 |
实验结论:上述碳酸钠样品中混有碳酸氢钠杂质
II.为了测定该碳酸钠的纯度,甲组同学继续设计了如下实验:
①准确称取mg样品,加水溶解,向所得澄清液中加入过量氢氧化钡溶液;
②过滤、洗涤、干燥,所得固体质量为m1g;
③写出步骤①中碳酸氢钠发生的离子反应方程式为;
 试纸变蓝的气体一定是二氧化氮
C . 能使品红溶液褪色,加热褪色溶液又恢复红色的气体一定是
试纸变蓝的气体一定是二氧化氮
C . 能使品红溶液褪色,加热褪色溶液又恢复红色的气体一定是  D . 浓硫酸具有强氧化性,不能干燥
D . 浓硫酸具有强氧化性,不能干燥  、
、  、
、  等还原性气体
等还原性气体
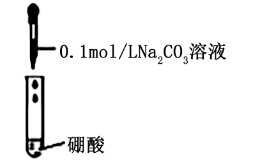
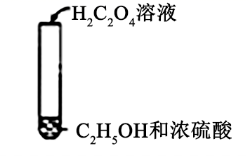
| 序号 | 试剂及操作 | 部分现象 | 结论 |
| A | | 滴入稀盐酸后铜片继续溶解,产生无色气体,在试管口处变为淡棕色 | 盐酸具有氧化性 |
| B | | 有气体生成 | 酸性: 硼酸强于碳酸 |
| C | | 加热后产生有香味物质 | H2C2O4可发生酯化反应 |
| D | | 试管内红色褪去 | SO2具有漂白性 |

-
(1) Ⅰ.利用装置A和C制备Sr3N2
装置A中仪器b的名称是,a导管的作用是。
-
(2) 写出由装置A制备N2的化学方程式:。
-
(3) 操作中,应先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,这样操作的理由是。
-
(4) Ⅱ.利用装置B和C制备Sr3N2。(已知:氧气可被连苯三酚溶液定量吸收。)
写出装置B的NaOH溶液中发生反应的离子方程式:。
-
(5) 装置C中广口瓶盛放的试剂是。
-
(6) Ⅲ.测定Sr3N2产品的纯度
取10.0g该产品,向其中加入适量的水,直接将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是。经改进后测得浓硫酸增重1.02g,则产品的纯度为。
 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:
-
(1) I.已知:焦炭、CO的标准燃烧热分别为
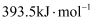 、
、 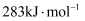 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: 
试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:
-
(2) 下列说法正确的是___________A . 将煤炭在空气中直接加强热进行干馏,制备生成水煤气的原料焦炭 B . 水煤气可经过催化合成获得液体燃料、碳氢化合物和含氧有机物 C . 水煤气也可采用高温下煤和水蒸气直接作用制得 D . 在恒压反应釜中,利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
-
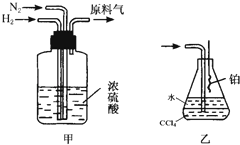
(3) II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。

A反应器中主要发生的反应为:

B反应器中主要发生的反应为:
主反应:

副反应:
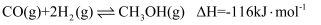
由进气口充入一定量含CO、
 、
、  、
、  的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、 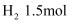 、
、 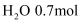 、
、 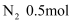 、
、 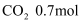 和
和 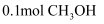 。
。已知标准平衡常数:
 ,其中
,其中  表示标准压强(
表示标准压强(  )
)  、
、 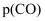 、
、  、
、  表示各组分的分压,如
表示各组分的分压,如  ,
, 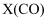 为体系中CO的物质的量分数
为体系中CO的物质的量分数T℃时,主反应的压强平衡常数

-
(4) 平衡时CO的转化率为
-
(5) 进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时
 的收率如下图所示
的收率如下图所示 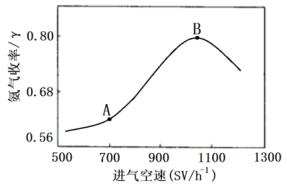
①曲线中A点到B点变化的原因是:
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的
 收率曲线。
收率曲线。
-
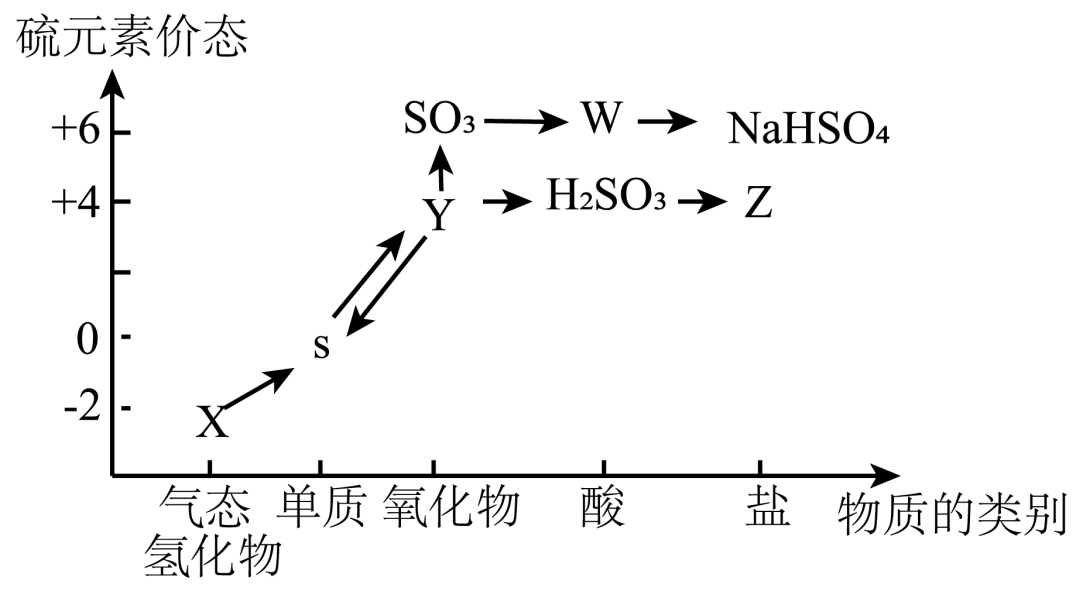
(1) Z为钠的正盐,在反应中既可作氧化剂,又可作还原剂。当Z作氧化剂时,理论上可被还原为____(填字母)。A . Na2S B . S C . H2SO4 D . Na2SO4
-
(2) W的浓溶液与碳单质在加热条件下发生反应的化学方程式为,反应中W表现的性质为。
-
(3) 若将Y气体通入足量的稀硝酸钡溶液中有白色沉淀生成,再滴入稀盐酸,沉淀无明显变化。请写出该反应的离子方程式:。
-
(4) 集居民区靠近硫酸工厂,为监测该居民区的空气中Y的含量是否超标(已知居民区的空气中Y的含量不超过0.15mg/m3),某化学小组进行如下实验:取标准状况下的空气20.00mL(含N2、O2、CO2、SO2等),缓慢通入足量氯水中,在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过能后将沉淀洗涤、干燥,称得其质量为0.233g。
①将上述空气缓慢通入足量氯水后所得溶液的pH(填“增大”或“减小)。
②检验沉淀是否洗涤干净的方法是。
③通过计算得出:该居民区的空气中Y的含量超标(填“已”或“未”)。
 B .
B . 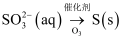 C . 稀
C . 稀 D .
D . 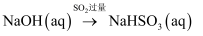
-
(1) 据汞的原子结构示意图
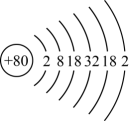 , 汞在第周期。
, 汞在第周期。
-
(2) ①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积L。
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
_Al2O3+_N2+_C—_AlN+_CO
-
(3) 利用元素的化合价推测物质的性质是化学研究的重要于段。如图是硫元素的“价—类”二维图:
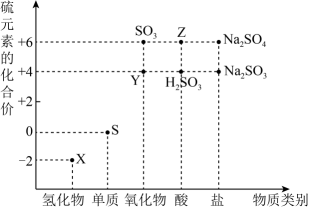
①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式)。
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为。
 Mg+Cl2↑
Mg+Cl2↑