第一章 物质结构 元素周期律 知识点题库
原子的最外电子层中有个电子(最外层为层时,最多有个电子)的结构是相对稳定的结构.
短周期元素A、B、C、D的原子序数依次增大,B和C为同周期的金属元素,A和B的最外层电子数之和等于D元素原子的最外层电子数,A、B、C、D四种元素最高价氧化物对应的水化物分别为甲、乙、丙、丁,他们之间存在如图所示的反应关系(图中用“—“相连的两种物质间可发生反应),下列说法正确的是( )
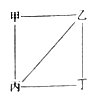
A . 简单离子半径大小顺序:D>B>A>C
B . 等物质的量的BA3和B3A中含有的阴阳离子总数相等
C . 元素A和D的简单氢化物分子间仅存在范德华力
D . 元素B和D形成化合物的水溶液呈碱性
下列有关化学用语正确的是( )
A . 二氧化碳的结构式:O—C—O
B . 原子核内有10个中子的氧原子:  O
C . F原子结构示意图:
O
C . F原子结构示意图:  D . MgCl2的电子式:
D . MgCl2的电子式: 
 O
C . F原子结构示意图:
O
C . F原子结构示意图: 
下列电子排布式表示的基态原子中,第一电离能最小的是( )
A . ns2np3
B . ns2np5
C . ns2np4
D . ns2np6
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最低负价等于X、Z的最低负价之和,Y的周期数是族序数的3倍,W的简单氢化物与X的简单氢化物化合形成的盐中既含离子键又含共价键。下列说法正确的是( )
A . Y与X形成化合物的水溶液呈碱性.
B . 常压下,单质的沸点:W>Z
C . 原子半径:W<X<Y<Z
D . W的氧化物的水化物的酸性比Z的弱
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,常温下0.01 mol·L-1 Z的最高价氧化物对应的水化物溶液的pH=12,W在元素周期表中的族序数是周期数的2倍。下列说法正确的是( )
A . 工业上常用电解法冶炼Z单质
B . 原子半径:r (Z)>r (W)>r(Y)>r(X)
C . X简单气体氢化物的稳定性比Y的强
D . W的最高价氧化物对应的水化物的酸性比Y强
下列关于化学键及晶体的说法中,错误的是( )
A . Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大
B . NaOH和NH4Cl化学键类型相同
C . N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构
D . 石英晶体和干冰晶体熔沸点不同,是因为所含化学键类型不同
下列有关化学键、氢键和范德华力的叙述中,错误的是( )
A . 金属键是金属离子与“电子气”之间的强烈作用,金属键无方向性和饱和性
B . 共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性
C . 范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大
D . 氢键不是化学键而是一种较弱的作用力,所以氢键只存在于分子与分子之间
下列事实能说明氯元素原子得电子能力比硫元素原子强的是( )
①还原性:Cl-<S2-
②HCl 的酸性比 H2S 强
③HCl 的稳定性比 H2S 强
④HCl 的还原性比 H2S 强
⑤HClO 的酸性比 H2SO4 强
⑥Cl2 能与 H2S 反应生成 S
⑦ Cl2 与铁反应生成 FeCl3 , 而 S 与铁反应生成 FeS
A . ③④⑤⑦
B . ②③⑥⑦
C . ①③⑥⑦
D . ①②③④⑤⑥⑦
下列叙述中错误的是( )
A . 氧化性:Na +<Mg2+<Al3+
B . 沸点:H2Se>H2S>H2O
C . 稳定性:HF>HCl>HBr
D . 酸性:HClO4>H2SO4>H3PO4
在乙烯分子中有5个σ键和1个π键,它们分别是( )
A . sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
B . sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C . C-H之间是sp2杂化轨道形成σ键,C-C之间是未杂化的2p轨道形成π键
D . C-C之间是sp2杂化轨道形成σ键,C-H之间是未杂化的2p轨道形成π键
下列说法中正确的是( )
A . 在多电子原子中,p轨道电子能量一定高于s轨道电子能量
B . 电子在3PX与3PZ轨道上的运动状态不相同
C . N原子的电子排布  违背了泡利不相容原理
D . B原子由
违背了泡利不相容原理
D . B原子由 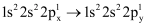 时,由基态转化为激发态,形成发射光谱
时,由基态转化为激发态,形成发射光谱
 违背了泡利不相容原理
D . B原子由
违背了泡利不相容原理
D . B原子由 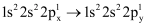 时,由基态转化为激发态,形成发射光谱
时,由基态转化为激发态,形成发射光谱
有四种核素:① 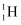 ②
②  ③
③  ④
④  。
。
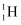 ②
②  ③
③  ④
④  。
。
-
(1) 上述核素中互为同位素的是(填序号)。
-
(2) ①和②形成的化学键是(填“极性键”或“非极性键”)。
-
(3) 由上述两种元素形成的物质中,任写一种含离子键的物质的电子式。
元素X的原子有3个电子层,最外层有1个电子。这种元素位于周期表的( )
A . 第4周期ⅢA族
B . 第4周期ⅦA族
C . 第3周期IIB族
D . 第3周期IA族
下列说法错误的是( )
A . 气态和液态物质都是由分子构成的
B . 超分子的重要特征是分子识别和自组装
C . 大多数晶体都是四种典型晶体之间的过渡晶体
D . 石墨晶体中既有共价键和范德华力又有类似金属的导电性属于混合型晶体
-
(1) I.请回答下列问题:
常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有 mol 氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:。
-
(2) 比较酸性的相对强弱:H2SO4HClO4 (填“>”“=”或“<”),已知能发生反应:H2SO4(浓)+NaClO4
 HClO4+NaHSO4 , 说明该反应能发生的理由。
HClO4+NaHSO4 , 说明该反应能发生的理由。
-
(3) Ⅱ.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝。查阅资料:①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4Cl
 NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2
NaCl+N2↑+2H2O;②工业制氮化铝:Al2O3+3C+N2  2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。 氮化铝的制备
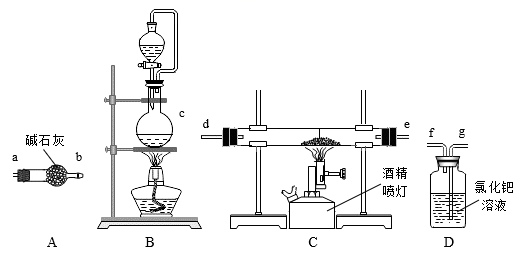
①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→。 (根据实验需要,上述装置可使用多次)
②D装置内氯化钯溶液的作用可能是。
-
(4) AlN粉末会缓慢发生水解反应,粒径为100 nm的AlN粉末水解时溶液pH的变化如下图所示。

①AlN粉末水解的化学方程式是。
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线。
UO2与铀氮化物是重要的核燃料,已知:3(NH2)4[ UO2(CO3)3] 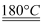 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
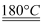 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
-
(1) 基态氮原子价电子轨道表示式为。
-
(2) 反应所得气态化合物中属于非极性分子的是(填化学式)。
-
(3) 某种铀氮化物的晶体结构与NaCl的结构相似。NaCl的Borm-Haber循环如图甲所示。已知:元素的一个基态气态原子获得电子成为气态阴离子时所放 出的能量称为电子亲和能。下列有关说法正确的是 (填序号)。
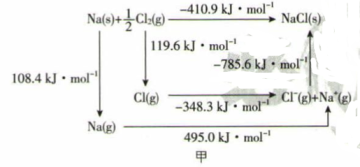
a.Cl-Cl 键的键能为119.6 kJ·mol -1
b.Na的第一电离能为603.4kJ·mol-1
c. NaCl的晶格能为785.6 kJ·mol-1
d. Cl的第一电子亲和能为348.3 kJ·mol-1
-
(4) 依据VSEPR理论推测
 的空间结构为。分子中的大π键可用符号
的空间结构为。分子中的大π键可用符号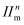 表示,其中m代表参与形成大π键的原子数,n代表参与形成大,π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大,π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为 。
中的大π键应表示为 。
-
(5) UO2可用于制备UF4:2UO2 + 5NH4HF2
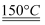 2UF4·2NH4F+3NH3↑+4H2O↑,其中
2UF4·2NH4F+3NH3↑+4H2O↑,其中 的结构可表示为[F--H……F]- , 反应中断裂的化学键有(填序号)。
的结构可表示为[F--H……F]- , 反应中断裂的化学键有(填序号)。
a.氢键b. 极性键c. 离子键d. 金属键e. 非极性键
-
(6) 铀氮化物的某两种晶胞如图乙所示:
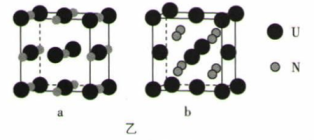
①晶胞a中铀元素的化合价为 ,与U原子距离相等且最近的U原子有个。
②已知晶体b的密度为dg·cm-1 , U原子的半径为r1cm,N原子的半径为r2cm,设NA为阿伏加德罗常数的值,则该晶胞原子的空间利用率为 (列出计算式)。
短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表ⅢA族,W与X属于同一主族。下列说法正确的是( )
A . W的氧化物对应的水化物均为强酸
B . X的简单氢化物的热稳定性比W的弱
C . 原子半径:r(Y)>r(Z)>r(W)
D . 由X、Y组成的化合物中均只含离子键
X、Y、Z、Q、R五种短周期主族元素,核电荷数依次增大,其相关信息如下表所示:
| 元素 | 相关信息 |
| X | 最高正价与最低负价之和为零 |
| Y | 组成的化合物种类最多的元素 |
| Z | 其单质与同主族的某单质混合可作核反应堆的导热剂 |
| Q | 最外层电子数是最内层的3倍 |
下列说法正确的是( )
A . 原子半径大小为:R>Q>Y>Z>X
B . 最简式为YX2的化合物均能使溴水褪色
C . YQ2与YR4都为共价化合物
D . 最高价氧化物对应的水化物酸性强弱:Q>R>Y
短周期主族元素R、X、Y、Z、W的原子序数依次增大,由这五种元素组成的一种化合物M常用作食品的增味剂,M的结构式如图所示。下列说法正确的是( )
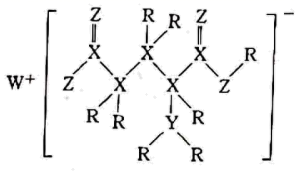
A . 原子半径:X>Y
B . 由R、Y、Z三种元素形成的化合物均为共价化合物
C . 熔点:W2Z>R2Z
D . 工业上采用电解熔融的W2Z制备W单质
最近更新



