第一章 物质结构 元素周期律 知识点题库
已知:H2(g)+Cl2(g) = 2HCl(g)反应的能量变化示意图如下:

下列说法正确的是( )
A . 点燃条件和光照条件下,反应的ΔH不同
B . 反应的ΔH约为[2c- (a+b)]kJ·mol-1
C . “假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D . 反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
现有四种元素基态原子电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5.则下列有关比较中正确的是( )
A . 单电子数:③>①
B . 原子半径:④>③
C . 电负性:②>①
D . 最高正化合价:④>①
下列物质中既含有共价键又含有离子键的是( )
A . H2O
B . MgCl2
C . HClO
D . Na2O2
短周期主族元素W、X、Y、Z原子序数依次增大,其中W元素原子的最外层电子数是内层电子数的两倍。X与Z同主族,两原子的核外电子数之和为24。Y的原子半径是所有短周期主族元素中最大的。下列说法正确的是( )

A . 简单离子半径:Z>Y>X
B . 如图所示实验可证明非金属性:Cl>Z
C . W、Y、Z的单质分别与X2反应时,X2用量不同产物均不同
D . Y分别与X、Z形成二元化合物中不可能存在共价键
下列说法正确的是( )
A . CaO与水反应过程中,有共价键的断裂和形成
B . H2O的热稳定性比H2S强,是由于H2O的分子间作用力较大
C . KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合物
D . 葡萄糖、二氧化碳和足球烯(C60)都是共价化合物,它们的晶体都属于分子晶体
现有部分短周期元素的性质或原子结构如表所示:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上电子数是K层上电子数的3倍 |
|
X |
最外层电子数是次外电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
-
(1) 元素X位于元素周期表的第周期族;
-
(2) 元素Y的原子结构示意图为。
-
(3) 元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
下列各组元素性质递变情况不正确的是( )
A . 原子半径N<P<Cl
B . 最外层电子数Li<Be<B
C . 金属性Na<K<Rb
D . 氢化物稳定性P<S<Cl
短周期主族元素W、X、Y、Z的原子序数依次增大,Wˉ与X+电子层结构相同,Y所在周期数与族序数相同,Z的最高价氧化物的水化物为强酸。下列说法正确的是( )
A . 工业上用电解XZ的水溶液制备X单质
B . W、Z对应氢化物的沸点:W>Z
C . 周期表中Z的氧化物对应水化物的酸性最强
D . Y是四种元素中简单离子半径最大的
请回答下列问题:
-
(1) Li+半径小于H- , 请解释原因。
-
(2) 有机物
 中,同一平面的碳原子数至少为个。
中,同一平面的碳原子数至少为个。
-
(3) 白磷的分子结构为
 ,分子中磷原子与共价键数目之比为。
,分子中磷原子与共价键数目之比为。
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A . 原子半径:Z>Y>X
B . 气态氢化物的热稳定性:W>R
C . WX3和水反应生成的化合物是离子化合物
D . X元素在自然界中存在同素异形现象
四种短周期主族元素W、X、Y、Z的原子序数依次增大,X、Y、Z同周期且X的原子半径是短周期主族元素原子中最大的,W、Y、Z的相对位置如图。其中Z的单质在常温下呈气态。下列说法正确的是( )

A . 简单离子半径:W<Y<Z
B . 化合物XZW可作消毒剂
C . 化合物X2Y中含有共价键
D . 最高价氧化物对应水化物的酸性:Y>Z
下列说法错误的是( )
A . 甘油和水可以任意比例互溶
B . H2O的沸点高于HF, 是因为前者的氢键作用较大
C . 氢氟酸水溶液中氢键的类型有 F—H•••F、F—H•••O、O—H•••F、O—H•••O
D .  比
比  熔点低的原因是前者形成分子内氢键
熔点低的原因是前者形成分子内氢键
 比
比  熔点低的原因是前者形成分子内氢键
熔点低的原因是前者形成分子内氢键
氰气的分子式为(CN)2 , 结构式为N≡C-C≡N,性质与卤素单质相似,下列叙述正确的是( )
A . 分子中既有极性键,又有非极性键
B . 分子中N≡C键的键长大于C-C键的键长
C . 该分子为极性分子
D . 该气体不能与氢氧化钠溶液反应
下表是元素周期表短周期的一部分,请参照元素①~⑨在表中的位置,回答下列问题。
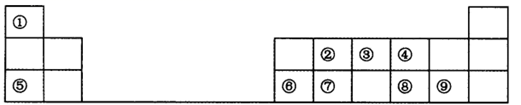
-
(1) 元素②在周期表中的位置是。
-
(2) 元素⑤和⑨形成的化合物的电子式为。
-
(3) 元素④、⑤、⑥形成的简单离子的半径依次(填“增大”“减小”或“不变”)。
-
(4) 表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是(填化学式)。
-
(5) 元素⑥形成的单质可与⑤的最高价氧化物对应的水化物发生反应,其反应的离子方程式为
-
(6) 在一定条件下,①与③可形成一种化合物X,其相对分子质量与O2相同,且X可在纯氧中燃烧,所得产物对环境均无污染,则X燃烧的化学方程式为
下列物质中,属于只含有离子键的离子化合物的是( )
A . CO2
B . Ca(OH)2
C . HF
D . Na2O
汽车安全气囊内的气体发生剂主要是叠氮化钠  、
、  等物质。下列说法错误的是( )
等物质。下列说法错误的是( )
 、
、  等物质。下列说法错误的是( )
等物质。下列说法错误的是( )
A . 强烈碰撞时,  转化为氮化钠的化学方程式是
转化为氮化钠的化学方程式是  B . 叠氮化钠中含有离子键和共价键
C .
B . 叠氮化钠中含有离子键和共价键
C .  的电子式是
的电子式是  D .
D .  中O元素位于周期表ⅥA族、Fe元素属于ⅦB族
中O元素位于周期表ⅥA族、Fe元素属于ⅦB族
 转化为氮化钠的化学方程式是
转化为氮化钠的化学方程式是  B . 叠氮化钠中含有离子键和共价键
C .
B . 叠氮化钠中含有离子键和共价键
C .  的电子式是
的电子式是  中O元素位于周期表ⅥA族、Fe元素属于ⅦB族
中O元素位于周期表ⅥA族、Fe元素属于ⅦB族
利用下列装置可进行物质或元素性质的探究实验。

-
(1) I.验证氯、碳、硅元素的非金属性强弱
已知圆底烧瓶B中装有Na2CO3固体,试管C中装有Na2SiO3溶液,装置连接顺序为A→B→C,则A中所装试剂的化学式是。
-
(2) 仪器A的名称是。
-
(3) C装置中发生反应的离子方程式是。
-
(4) 通过以上实验说明氯、碳、硅的非金属性依次减弱,其判断依据是。
-
(5) II.通过置换反应验证氯、硫的非金属性强弱,设计装置连接顺序为A→B→C→D。
C试管中盛装的溶液不能选择(填正确答案标号)。
a.硫化钠溶液 b.亚硫酸钠溶液 c.氢硫酸
-
(6) 圆底烧瓶B中产生气体的化学方程式为。
-
(7) 证明氯的非金属性比硫强的实验现象是。
-
(8) D装置的作用是。
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的基态原子价电子排布为nsnnpn+1;C元素为最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
-
(1) G的元素名称为 。
-
(2) A、B、C三种元素电负性由大到小的顺序为(用元素符号表示),第一电离能:DAl(填”>”“<”或“=”),其原因是
-
(3) E3+的离子符号为。
-
(4) F元素基态原子的电子排布式为 。
-
(5) G元素可能的性质为____。(填序号)。A . 其单质可用于生产半导体材料 B . 其电负性大于磷 C . 其最高价氧化物对应的水化物是强酸 D . 其第一电离能较小
按要求完成下列问题
-
(1) Ⅰ.下列几种微粒或物质
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧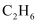 ⑨
⑨ ⑩
⑩
互为同位素的是,(填序号,下同)质子数不同中子数相同的是。
-
(2) 互为同素异形体的是,互为同分异构体的是。
-
(3) Ⅱ.下表为四种短周期元素的相关信息:
元素
元素的相关信息
Y
原子最外层电子数是次外层电子数的2倍
Z
地壳中含量最多的元素
Q
短周期中金属性最强
R
常温下,R的单质是淡黄色固体,常在火山喷口附近沉积
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
R元素在周期表中的位置是。
-
(4) 写出Q与R元素按2:1组成常见物质的电子式的形成过程。
-
(5) Z、Q、R相比,其原子半径由大到小的顺序是。
-
(6) Y与R相比,非金属性较强的是,能证明这一结论的事实是。(用化学方程式表示)
-
(7) Q单质在过量Y的最高价氧化物中燃烧,生成黑色颗粒并产生大量白烟,写出该反应的化学方程式。
一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质子;元素
的原子核只有1个质子;元素 、
、 、
、 原子序数依次增大,且均位于
原子序数依次增大,且均位于 的下一周期;元素
的下一周期;元素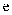 的原子比
的原子比 原子多8个电子。下列说法错误的是( )
原子多8个电子。下列说法错误的是( )
 的原子核只有1个质子;元素
的原子核只有1个质子;元素 、
、 、
、 原子序数依次增大,且均位于
原子序数依次增大,且均位于 的下一周期;元素
的下一周期;元素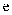 的原子比
的原子比 原子多8个电子。下列说法错误的是( )
原子多8个电子。下列说法错误的是( )
A .  是一种强酸
B . 非金属性:
是一种强酸
B . 非金属性: C . 原子半径:
C . 原子半径: D .
D .  中,
中, 的化合价为+2价
的化合价为+2价
 是一种强酸
B . 非金属性:
是一种强酸
B . 非金属性: C . 原子半径:
C . 原子半径: D .
D .  中,
中, 的化合价为+2价
的化合价为+2价
最近更新



