第一章 物质结构 元素周期律 知识点题库
X、Y、Z、W是原子序数依次增大的短周期主族元素.通常状况下,X与W元素均能形成﹣1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素.X、Z和W的原子最外层电子教之和为20.回答下列问题:
-
(1) X在兀素周期表中的位置是.
-
(2) X和Y元素简单离子的半径较大的是(填离子符号);Z和W元素气态氢化物的稳定性较强的是(填化学式).
-
(3) Y的氧化物中既含离子键又含共价键的是(用电子式表示).
-
(4) Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为.
下列化合物分子中只含σ键不含π键的是 ( )
A . CO2
B . COCl2
C . C2H2
D . H2O2
按Li、Na、K、Rb、Cs顺序逐渐递增的性质是()
A . 单质的还原性
B . 阳离子的氧化性
C . 单质的密度
D . 单质的熔点
下列说法正确的是( )
A . Li、Be、B原子半径依次增大
B . Cl、Br、I含氧酸的酸性依次减弱
C . Na与Na+化学性质相同
D . 147N与157N得电子能力相同
下列物质中既含有非极性键,又含有离子键的是( )
A . MgBr2
B . H2O2
C . Na2O2
D . NH4Cl
根据元素的核电荷数,不能确定的是( )
A . 原子核内质子数
B . 原子核内中子数
C . 原子最外层电子数
D . 原子核外电子数
地壳中含量最多的元素在周期表中的位置是( )
A . 第二周期 VIA 族
B . 第二周期ⅣA 族
C . 第三周期 VIA 族
D . 第三周期ⅣA 族
能证明硫元素的非金属性弱于氯元素的事实是( )
A . 通常情况下硫为浅黄色固体,而氯气为黄绿色的气体
B . 硫不溶于水而氯气溶于水
C . 跟金属或氢气反应时,硫被还原为  价,而氯被还原为
价,而氯被还原为  价
D . 跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯气氧化成高价态
价
D . 跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯气氧化成高价态
 价,而氯被还原为
价,而氯被还原为  价
D . 跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯气氧化成高价态
价
D . 跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯气氧化成高价态
乙炔经CaCl2等净化后,在N2中可催化生成聚乙炔。相关化学用语正确的是( )
A . 中子数为20的钙原子:20Ca
B . CaCl2的电子式:  C . N2的电子式:
C . N2的电子式:  D . 聚乙炔的结构简式:
D . 聚乙炔的结构简式: 
X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。Y元素的最高正价低于同族的M元素,金属元素Z的化合物ZX的电子总数为12。下列说法错误的是( )
A . 最高价氧化物对应水化物的酸性:Q>M
B . 原子半径:Y<M<Z
C . 化合物Z2Y2和X2Y2的晶体类型不同
D . X、Y和Q三种元素形成的化合物是强电解质
X、Y均为短周期元素,且X为第ⅠA族元素,Y为第ⅥA族元素,下列说法正确的是( )
A . X的原子半径一定大于Y的原子半径
B . 由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C . X2Y既可能是离子化合物,也可能是共价化合物
D . 由X、Y组成的化合物中,X、Y的原子个数比不可能是1∶1
我国科学家合成了一种新化合物,结构式如图所示。已知M、X、Y、Z、W、Q均为前20号主族元素,且原子序数依次增大,其中Q与M、Z与Y同主族;Z元素原子中的质子数是Y元素原子中的质子数的2倍。

回答下列问题:
-
(1) 写出W的离子结构示意图。
-
(2) Z、Q两种元素最简单离子半径的大小顺序为(用离子符号表示)。
-
(3) X元素的最低价氢化物的电子式是,写出实验室制取该氢化物的化学方程式。
-
(4) Q元素单质与金属钠性质相似,则Q的过氧化物中含有的化学键有(填化学键名称),写出该物质与水反应的离子方程式。
-
(5) 比较Z、W原子的得电子能力强弱。
方法一:比较Z、W两种元素最高价氧化物对应水化物的酸性强弱(用化学式回答);
方法二:比较单质的氧化性强弱,设计实验证明(请简述试剂、操作、现象、结论):。
A、B、C、D、E代表原子序数依次增大的5种元素,均位于周期表前四周期。请填空:
-
(1) A元素基态原子的价电子排布式为
 ,原子序数,基态原子核外电子排布式为:。能量最高的电子所处原子轨道的形状为形。
,原子序数,基态原子核外电子排布式为:。能量最高的电子所处原子轨道的形状为形。
-
(2) C元素的为最活泼的非金属元素,C的元素符号为,B的价电子排布图为。
-
(3) D的基态原子所具有的单电子数是前四周期基态原子中单电子数目最多的元素,D的元素符号为,其基态原子的电子排布式为。
-
(4) E元素基态原子的M层全充满,与A位于同一主族,其某种氧化物有剧毒。E元素的名称,原子结构示意图为。
下列各项比较中前者高于(或大于或强于)后者的是( )
A . CCl4和SiCl4的熔点
B . 对羟基苯甲醛(  )和邻羟基苯甲醛(
)和邻羟基苯甲醛(  )的沸点
C . I2在水中的溶解度和I2在CCl4溶液中的溶解度
D . H2SO3和H2SO4的酸性
)的沸点
C . I2在水中的溶解度和I2在CCl4溶液中的溶解度
D . H2SO3和H2SO4的酸性
南京大学某科研团队成功预测并首次大面积合成纳米多孔Cu-Al合金催化剂材料,实现高效率和大产率的电催化还原二氧化碳(CO2)生产乙烯(C2H4)。回答下列问题:
-
(1) Al元素在周期表中位于区,基态Cu原子的价电子排布式为。
-
(2) CO2和C2H4中C原子杂化方式分别为,物质的量相同的CO2和C2H4所含σ键数之比为。
-
(3) Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+ , 该配离子中配体的立体构型为。
-
(4) 工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是(填写化学式),从结构的角度解释可能的原因。
-
(5) Cu与O构成的某种化合物,其晶胞结构如图所示:

已知该晶胞参数为apm,阿伏加德罗常数的数值为NA , 则该晶体的密度ρ=g•cm-3(列出计算式即可)。
五种短周期元素A、B、C、D、E原子序数依次增大。B的最外层电子数是其电子层数的3倍;C、D、E的最高价氧化物对应水化物两两均可反应;A的单质在E的单质中能安静地燃烧,产生苍白色火焰。回答下列问题:
-
(1) B元素在元素周期表中的位置是,B、C、D形成的简单离子的半径由大到小的顺序是(用化学符号表示)。
-
(2) B与C能形成一种淡黄色的固体,其电子式为,它能用于呼吸面具的原因是(用其中一个化学方程式表示)。
-
(3) D的单质常用于焊接钢轨,请用化学方程式表示其反应原理。D、E的最高价氧化物对应水化物之间发生反应的离子方程式为。
含有极性键的非极性分子是( )
A . SiO2
B . CO2
C . N2
D . NaOH
在电池工业上,碳酸乙烯酯(EC)可作为锂电池电解液的优良溶剂,其结构为 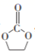 ,熔点为35℃。下列有关说法错误的是( )
,熔点为35℃。下列有关说法错误的是( )
A . 一个分子中有10个σ键
B . EC分子间能形成氢键
C . 分子中至少有4个原子共平面
D . EC由固态变成液态破坏了分子间的作用力
类推是一种经常采用的科研和学习方法,下列类推结论合理的是( )
A . 由单质铜和 反应生成
反应生成 , 推出单质铜和硫磺反应生成CuS
B . 由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C . 由氮元素的最高价含氧酸的酸性强于磷元素,推出氟元素的最高价含氧酸的酸性强于氯元素
D . 由金属Na在常温下与水剧烈反应,推出金属Cs在常温下也能与水剧烈反应
, 推出单质铜和硫磺反应生成CuS
B . 由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C . 由氮元素的最高价含氧酸的酸性强于磷元素,推出氟元素的最高价含氧酸的酸性强于氯元素
D . 由金属Na在常温下与水剧烈反应,推出金属Cs在常温下也能与水剧烈反应
 反应生成
反应生成 , 推出单质铜和硫磺反应生成CuS
B . 由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C . 由氮元素的最高价含氧酸的酸性强于磷元素,推出氟元素的最高价含氧酸的酸性强于氯元素
D . 由金属Na在常温下与水剧烈反应,推出金属Cs在常温下也能与水剧烈反应
, 推出单质铜和硫磺反应生成CuS
B . 由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C . 由氮元素的最高价含氧酸的酸性强于磷元素,推出氟元素的最高价含氧酸的酸性强于氯元素
D . 由金属Na在常温下与水剧烈反应,推出金属Cs在常温下也能与水剧烈反应
下列说法正确的是( )
A .  与
与 互为同位素
B .
互为同位素
B .  与
与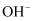 具有相同的质子数和电子数
C . 原子最外层电子数是2的元素一定处于IIA族
D . 最外层电子数比次外层电子数多的元素一定位于第2周期
具有相同的质子数和电子数
C . 原子最外层电子数是2的元素一定处于IIA族
D . 最外层电子数比次外层电子数多的元素一定位于第2周期
 与
与 互为同位素
B .
互为同位素
B .  与
与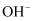 具有相同的质子数和电子数
C . 原子最外层电子数是2的元素一定处于IIA族
D . 最外层电子数比次外层电子数多的元素一定位于第2周期
具有相同的质子数和电子数
C . 原子最外层电子数是2的元素一定处于IIA族
D . 最外层电子数比次外层电子数多的元素一定位于第2周期
最近更新



