第дёҖз« зү©иҙЁз»“жһ„ е…ғзҙ е‘ЁжңҹеҫӢ зҹҘиҜҶзӮ№йўҳеә“
дёӢеҲ—еҲҶеӯҗдёӯжүҖжңүеҺҹеӯҗйғҪж»Ўи¶іжңҖеӨ–еұӮдёә8дёӘз”өеӯҗз»“жһ„зҡ„жҳҜпјҲ пјү
A . BCl3
B . NCl3
C . H2S
D . BeCl2
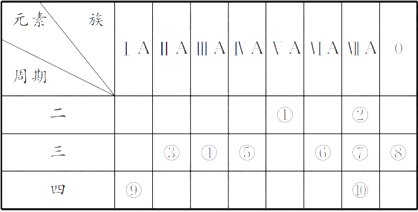
дёӢиЎЁдёәе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢиҜ·еӣһзӯ”жңүе…ій—®йўҳпјҡ
-
пјҲ1пјү в‘Өе’Ң⑧зҡ„е…ғзҙ з¬ҰеҸ·еҲҶеҲ«жҳҜе’ҢгҖӮ
-
пјҲ2пјү иЎЁдёӯжңҖжҙ»жіјзҡ„йҮ‘еұһжҳҜпјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·пјҢдёӢеҗҢ)гҖӮ
-
пјҲ3пјү иЎЁдёӯиғҪеҪўжҲҗдёӨжҖ§ж°ўж°§еҢ–зү©зҡ„е…ғзҙ жҳҜпјҢеҲҶеҲ«еҶҷеҮәиҜҘе…ғзҙ зҡ„ж°ўж°§еҢ–зү©дёҺв‘Ҙе’Ңв‘Ёзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡгҖӮ
-
пјҲ4пјү иҜ·и®ҫи®ЎдёҖдёӘе®һйӘҢж–№жЎҲпјҢжҜ”иҫғв‘Ұе’Ңв‘©зҡ„еҚ•иҙЁж°§еҢ–жҖ§зҡ„ејәејұпјҡгҖӮ
XгҖҒYгҖҒZгҖҒWдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„еӣӣз§Қзҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ пјҢе…¶дёӯXгҖҒZеҗҢдё»ж—ҸпјҢYеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°дёәж¬ЎеӨ–еұӮз”өеӯҗж•°зҡ„дёҖеҚҠпјҢXеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶ж ёеӨ–з”өеӯҗеұӮж•°зҡ„3еҖҚгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . жңҖз®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§пјҢW>Z>Y
B . еҚ•иҙЁзҡ„жІёзӮ№пјҡY>X>Z
C . з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„пјҡZ>W>X
D . Xзҡ„ж°ўеҢ–зү©дёӯеҸҜиғҪеҗ«жңүйқһжһҒжҖ§е…ұд»·й”®
еҺҹеӯҗз»“жһ„дёҺе…ғзҙ е‘ЁжңҹиЎЁгҖҒе…ғзҙ жҖ§иҙЁдёүиҖ…е…ізі»еҜҶеҲҮгҖӮA,B,D,E,FдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„еүҚеӣӣе‘Ёжңҹе…ғзҙ пјҢе…¶дёӯAзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶еҶ…еұӮз”өеӯҗж•°зҡ„2еҖҚпјҢB,D,EдёәеҗҢе‘Ёжңҹе…ғзҙ пјҢBеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҖ»ж•°жҳҜе…¶жңӘжҲҗеҜ№з”өеӯҗж•°зҡ„5еҖҚпјҢEеҺҹеӯҗжңҖеӨ–еұӮжңү1дёӘжңӘжҲҗеҜ№з”өеӯҗпјҢFеҺҹеӯҗж ёеӨ–жңү22з§ҚиҝҗеҠЁзҠ¶жҖҒзҡ„з”өеӯҗгҖӮ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү Fе…ғзҙ дҪҚдәҺе‘ЁжңҹиЎЁеҢәпјҢе…¶д»·з”өеӯҗжҺ’еёғеӣҫдёәпјҡгҖӮ
-
пјҲ2пјү B,D,Eдёүз§Қе…ғзҙ дёӯпјҢ第дёҖз”өзҰ»иғҪжңҖе°Ҹзҡ„жҳҜ (еЎ«е…ғзҙ з¬ҰеҸ·)пјӣеҶҷеҮәAD2зҡ„зӯүз”өеӯҗдҪ“ (еҲҶеӯҗе’ҢйҳҙзҰ»еӯҗеҗ„еҶҷдёҖз§Қ)гҖӮ
-
пјҲ3пјү AO2е’ҢDO2зҶ”зӮ№й«ҳзҡ„жҳҜпјҢеҺҹеӣ жҳҜгҖӮ
дёӢеҲ—е…ідәҺеҢ–еӯҰй”®е’ҢеҢ–еҗҲзү©зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еҢ–еӯҰй”®жҳҜдҪҝзҰ»еӯҗжҲ–еҺҹеӯҗзӣёз»“еҗҲзҡ„дёҖз§Қйқҷз”өеҗёеј•дҪңз”Ё
B . еҗ«жңүе…ұд»·й”®зҡ„еҢ–еҗҲзү©дёҚдёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©
C . е®Ңе…Ёз”ұйқһйҮ‘еұһе…ғзҙ еҪўжҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©
D . з”ұйҮ‘еұһе…ғзҙ е’ҢйқһйҮ‘еұһе…ғзҙ еҪўжҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү©
еңЁд№ҷзғҜеҲҶеӯҗдёӯжңү5дёӘПғй”®гҖҒдёҖдёӘПҖй”®пјҢе®ғ们еҲҶеҲ«жҳҜпјҲ пјү
A . sp2жқӮеҢ–иҪЁйҒ“еҪўжҲҗПғй”®гҖҒжңӘжқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗПҖй”®
B . sp2жқӮеҢ–иҪЁйҒ“еҪўжҲҗПҖй”®гҖҒжңӘжқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗПғй”®
C . C-Hд№Ӣй—ҙжҳҜsp2жқӮеҢ–еҪўжҲҗзҡ„Пғй”®пјҢC-Cд№Ӣй—ҙжҳҜжңӘеҸӮеҠ жқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗзҡ„Пғй”®
D . C-Cд№Ӣй—ҙжҳҜsp2еҪўжҲҗзҡ„Пғй”®пјҢC-Hд№Ӣй—ҙжҳҜжңӘеҸӮеҠ жқӮеҢ–зҡ„2pиҪЁйҒ“еҪўжҲҗзҡ„ПҖй”®
е·ІзҹҘе…ғзҙ XгҖҒYзҡ„ж ёз”өиҚ·ж•°еҲҶеҲ«жҳҜaгҖҒb,е®ғ们зҡ„зҰ»еӯҗXm+гҖҒYnвҲ’зҡ„ж ёеӨ–з”өеӯҗжҺ’еёғзӣёеҗҢ,еҲҷдёӢеҲ—е…ізі»ејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . a=b+m+n
B . a=bвҲ’m+n
C . a=b+mвҲ’n
D . a=bвҲ’mвҲ’n
е…ғзҙ е‘ЁжңҹиЎЁзҹӯе‘Ёжңҹдёӯе…ӯз§Қе…ғзҙ зҡ„еҺҹеӯҗеәҸж•°дёҺдё»иҰҒеҢ–еҗҲд»·зҡ„е…ізі»еҰӮеӣҫ:

-
пјҲ1пјү EеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜгҖӮ
-
пјҲ2пјү CгҖҒDгҖҒFеҺҹеӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ3пјү AгҖҒBгҖҒCзҡ„еҚ•иҙЁдёҺж°ўж°”еҸҚеә”еү§зғҲзЁӢеәҰз”ұејәеҲ°ејұзҡ„йЎәеәҸ.пјҲз”ЁеҚ•иҙЁзҡ„еҢ–еӯҰ ејҸиЎЁзӨәпјүгҖӮ
-
пјҲ4пјү еә”з”Ёе…ғзҙ е‘ЁжңҹеҫӢе’Ңе…ғзҙ е‘ЁжңҹиЎЁзҡ„зҹҘиҜҶ,еҶҷеҮәDе’ҢEеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸгҖҒпјҲеҶҷ2з§ҚпјүгҖӮ
-
пјҲ5пјү еҲӨж–ӯFзҡ„еҚ•иҙЁе’ҢEзҡ„жңҖз®ҖеҚ•ж°ўеҢ–зү©д№Ӣй—ҙиғҪеҗҰеҸ‘з”ҹеҸҚеә”пјҢиӢҘиғҪеҲҷеҶҷеҮәеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ,иӢҘдёҚиғҪеҲҷиҜҙжҳҺзҗҶз”ұ
еҮҸе°‘дәӨйҖҡдәӢж•…йҷӨйҒөе®ҲдәӨйҖҡ法规е’ҢжӯЈзЎ®й©ҫ驶еӨ–пјҢиў«еҠЁе®үе…ЁжҺӘж–Ҫд№ҹжһҒдёәйҮҚиҰҒпјҢжұҪиҪҰзҡ„е®үе…Ёж°”еӣҠеҶ…жңүеҸ ж°®еҢ–й’ (NaN3)дёҺзЎқй…ёй“ө(NH4NO3)зӯүзү©иҙЁгҖӮеҪ“жұҪиҪҰеңЁй«ҳйҖҹиЎҢ驶дёӯеҸ—еҲ°зҢӣзғҲж’һеҮ»ж—¶пјҢиҝҷдәӣзү©иҙЁдјҡиҝ…йҖҹеҸ‘з”ҹеҸҚеә”пјҢдә§з”ҹеӨ§йҮҸж°”дҪ“пјҢе……ж»Ўж°”еӣҠпјҢд»ҺиҖҢдҝқжҠӨй©ҫд№ҳдәәе‘ҳе®үе…ЁгҖӮ
-
пјҲ1пјү дёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ_____________гҖӮA . йҒ“и·Ҝиө·йӣҫдёҺH2OеҲҶеӯҗдёӯеҢ–еӯҰй”®ж–ӯиЈӮзӣёе…і B . NH4NO3дёӯеҸӘеҗ«жңүжһҒжҖ§е…ұд»·й”® C . NaN3еҸ—еҲ°зҢӣзғҲж’һеҮ»дёҺNH4NO3еҸ‘з”ҹеҸҚеә”ж—¶еҢ–еӯҰй”®дёҖе®ҡж–ӯиЈӮ D . NaN3гҖҒNH4NO3еқҮеұһдәҺзҰ»еӯҗеҢ–еҗҲзү©
-
пјҲ2пјү еҸ ж°®еҢ–й’ жҳҜдёҖз§Қж— иүІжҷ¶дҪ“пјҢе№ҝжіӣз”ЁдәҺжұҪиҪҰе®үе…Ёж°”еӣҠеҸҠеҢ–е·ҘеҗҲжҲҗзӯүгҖӮеёёи§Ғзҡ„дёӨз§ҚеҲ¶еӨҮж–№жі•пјҡ2NaNH2+N2O=NaN3+NaOH+NH3пјӣ3NaNH2+NaNO3=NaN3+3NaOH+NH3вҶ‘гҖӮ
в‘ еҶҷеҮәNaNH2зҡ„з”өеӯҗејҸпјҡгҖӮ
в‘ЎNaOHеӣәдҪ“дёӯеҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢжңүгҖӮ
-
пјҲ3пјү е·ІзҹҘXгҖҒYгҖҒZгҖҒWжҳҜеӣӣз§Қзҹӯе‘Ёжңҹе…ғзҙ пјҢдё”еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮWеҺҹеӯҗзҡ„иҙЁеӯҗж•°зӯүдәҺYгҖҒZеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’ҢгҖӮYдёҺXеҪўжҲҗзҡ„еҲҶеӯҗдёӯжңү3дёӘе…ұд»·й”®пјҢXгҖҒYгҖҒZеҪўжҲҗзҡ„еёёи§ҒеҢ–еҗҲзү©жҳҜжұҪиҪҰе®үе…Ёж°”еӣҠдёӯзҡ„дёҖз§ҚеЎ«е……зү©гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
в‘ з”ұд»ҘдёҠе…ғзҙ дёӨдёӨеҪўжҲҗзҡ„еҢ–еҗҲзү©дёӯпјҢжә¶дәҺж°ҙжҳҫзўұжҖ§зҡ„ж°”жҖҒж°ўеҢ–зү©зҡ„з”өеӯҗејҸдёәпјҢе…¶жүҖеҗ«зҡ„еҢ–еӯҰй”®еұһдәҺпјӣеҗ«жңүжһҒжҖ§е…ұд»·й”®е’ҢйқһжһҒжҖ§е…ұд»·й”®зҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸдёәгҖӮ
в‘Ўз”ұXгҖҒYгҖҒZеҪўжҲҗзҡ„еёёи§ҒеҢ–еҗҲзү©дёҺWзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„еӣәдҪ“еҠ зғӯеҪўжҲҗдёӨз§Қж°ўеҢ–зү©зҡ„еҸҚеә”иҝҮзЁӢдёӯпјҢеҸҚеә”зү©еҢ–еӯҰй”®ж–ӯиЈӮзҡ„зұ»еһӢжңүгҖӮ
еҜҝеұұзҹіM4[N4Y10(YX)8]жҳҜжҲ‘еӣҪеӣӣеӨ§еҚ°з« зҹід№ӢйҰ–пјҢиў«з§°дёәеӣҪзҹігҖӮXгҖҒYгҖҒMгҖҒNжҳҜеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹе…ғзҙ пјҢMе…ғзҙ жҳҜең°еЈідёӯеҗ«йҮҸжңҖй«ҳзҡ„йҮ‘еұһе…ғзҙ пјҢNе…ғзҙ зҡ„еҚ•иҙЁеёёз”ЁжқҘеҲ¶йҖ еӨӘйҳіиғҪз”өжұ пјҢX3Y+е’ҢYX-еҗ«жңүзӣёеҗҢзҡ„з”өеӯҗж•°гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еҸҜд»ҘеҶҷжҲҗж°§еҢ–зү©еҪўејҸ2M2Y3В·4NY2В·4X2Y
B . Mзҡ„ж°§еҢ–зү©еұһдәҺзўұжҖ§ж°§еҢ–зү©
C . 第82еҸ·е…ғзҙ дёҺMдҪҚдәҺеҗҢдёҖдё»ж—Ҹ
D . Nзҡ„жңҖй«ҳд»·ж°§еҢ–зү©жә¶дәҺж°ҙжҳҫй…ёжҖ§
еҰӮеӣҫжҳҜе…ғзҙ е‘ЁжңҹиЎЁзҡ„дёҖйғЁеҲҶпјҢдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲ пјү
| S | Cl |
| Se | Br |
A . иҝҳеҺҹжҖ§пјҡSe2->S2->Cl-
B . зғӯзЁіе®ҡжҖ§пјҡHCl>H2Se>HBr
C . еҺҹеӯҗеҚҠеҫ„пјҡSe>Cl>S
D . й…ёжҖ§пјҡHBrO4>HClO4>H2SO4
4з§ҚзӣёйӮ»дё»ж—Ҹзҹӯе‘Ёжңҹе…ғзҙ зҡ„зӣёеҜ№дҪҚзҪ®еҰӮиЎЁпјҢе…ғзҙ xзҡ„еҺҹеӯҗж ёеӨ–з”өеӯҗж•°жҳҜmзҡ„2еҖҚпјҢyзҡ„ж°§еҢ–зү©е…·жңүдёӨжҖ§пјҺ  з§°дёәжӢҹеҚӨзҙ пјҢжҖ§иҙЁдёҺеҚӨзҙ зӣёдјјпјҺдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
з§°дёәжӢҹеҚӨзҙ пјҢжҖ§иҙЁдёҺеҚӨзҙ зӣёдјјпјҺдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
 з§°дёәжӢҹеҚӨзҙ пјҢжҖ§иҙЁдёҺеҚӨзҙ зӣёдјјпјҺдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
з§°дёәжӢҹеҚӨзҙ пјҢжҖ§иҙЁдёҺеҚӨзҙ зӣёдјјпјҺдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү | M | N | ||
| X | Y |
A . XдҪҚдәҺдёүе‘Ёжңҹ IIAпјҢе…¶еҚ•иҙЁеҸҜйҮҮз”Ёз”өи§ЈзҶ”иһҚ 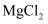 еҲ¶еӨҮ
B . е…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҢй…ёжҖ§жңҖејәзҡ„жҳҜ
еҲ¶еӨҮ
B . е…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҢй…ёжҖ§жңҖејәзҡ„жҳҜ 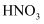 C . ж°”дҪ“еҲҶеӯҗ
C . ж°”дҪ“еҲҶеӯҗ  зҡ„з”өеӯҗејҸдёә
зҡ„з”өеӯҗејҸдёә  D .
D .  е…¶дёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә
е…¶дёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә 
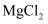 еҲ¶еӨҮ
B . е…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҢй…ёжҖ§жңҖејәзҡ„жҳҜ
еҲ¶еӨҮ
B . е…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©дёӯпјҢй…ёжҖ§жңҖејәзҡ„жҳҜ 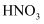 C . ж°”дҪ“еҲҶеӯҗ
C . ж°”дҪ“еҲҶеӯҗ  зҡ„з”өеӯҗејҸдёә
зҡ„з”өеӯҗејҸдёә  е…¶дёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә
е…¶дёҺж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә 
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . M2+зҰ»еӯҗж ёеӨ–жңүaдёӘз”өеӯҗпјҢbдёӘдёӯеӯҗпјҢMеҺҹеӯҗз¬ҰеҸ·дёә 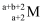 B . N2еҲҶеӯҗзҡ„з»“жһ„ејҸпјҡN=N
C . ж¬Ўж°Ҝй…ёзҡ„з”өеӯҗејҸпјҡ
B . N2еҲҶеӯҗзҡ„з»“жһ„ејҸпјҡN=N
C . ж¬Ўж°Ҝй…ёзҡ„з”өеӯҗејҸпјҡ  D . ж°ҜзҰ»еӯҗ(Cl-)зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
D . ж°ҜзҰ»еӯҗ(Cl-)зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ 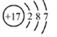
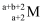 B . N2еҲҶеӯҗзҡ„з»“жһ„ејҸпјҡN=N
C . ж¬Ўж°Ҝй…ёзҡ„з”өеӯҗејҸпјҡ
B . N2еҲҶеӯҗзҡ„з»“жһ„ејҸпјҡN=N
C . ж¬Ўж°Ҝй…ёзҡ„з”өеӯҗејҸпјҡ
жҹҗжңүжңәзү©еҸҜеӮ¬еҢ–еӨҡж°ҹиҠізғғзҡ„еҸ–д»ЈеҸҚеә”пјҢжңәзҗҶеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү

A . еӣҫдёӯ1гҖҒ3гҖҒ6жҳҜеӮ¬еҢ–еүӮ
B . иҝҮзЁӢдёӯв‘ еҺҹеӯҗеҲ©з”ЁзҺҮдёә100%
C . иҝҮзЁӢв‘ЎдёӯжңүйқһжһҒжҖ§й”®дёҺжһҒжҖ§еҒҘзҡ„ж–ӯиЈӮдёҺеҪўжҲҗ
D . 4дёәCH3COCH2NH2ж—¶пјҢ7жҳҜ 

зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWгҖҒMзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјӣXзҡ„ж°ўеҢ–зү©з§Қзұ»з№ҒеӨҡпјҢе…¶дёӯеҗ«ж°ўйҮҸжңҖй«ҳзҡ„дёә25%пјӣZе’ҢWзҡ„еҹәжҖҒеҺҹеӯҗеқҮж»Ўи¶іsиҪЁйҒ“з”өеӯҗжҖ»ж•°е’ҢpиҪЁйҒ“дёҠзҡ„з”өеӯҗжҖ»ж•°зӣёзӯүпјӣMжҳҜеҗҢе‘Ёжңҹдёӯз”өиҙҹжҖ§жңҖеӨ§зҡ„е…ғзҙ гҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . 第дёҖз”өзҰ»иғҪпјҡXпјңZпјңY
B . Yзҡ„з®ҖеҚ•ж°ўеҢ–зү©еҸҜз”ЁдҪңеҲ¶еҶ·еүӮ
C . Xе’ҢZгҖҒXе’ҢMеқҮеҸҜд»ҘеҪўжҲҗеҗ«жңүжһҒжҖ§й”®зҡ„йқһжһҒжҖ§еҲҶеӯҗ
D . Wе’ҢMзҡ„еҢ–еҗҲзү©зҡ„ж°ҙжә¶ж¶ІдёӯпјҢйҳізҰ»еӯҗдёҺйҳҙзҰ»еӯҗж•°зӣ®д№ӢжҜ”зӯүдәҺ1пјҡ2
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 3gз”ұ  дёҺ
дёҺ  з»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«дёӯеӯҗжҖ»ж•°дёәNA
B . 1L0.1mol/LNaAlO2жә¶ж¶Ідёӯеҗ«
з»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«дёӯеӯҗжҖ»ж•°дёәNA
B . 1L0.1mol/LNaAlO2жә¶ж¶Ідёӯеҗ«  ж•°зӣ®дёә0.1NA
C . 4.4gз”ұд№ҷйҶӣдёҺд№ҷй…ёд№ҷй…Ҝз»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«ж°§еҺҹеӯҗжҖ»ж•°дёә0.1NA
D . 1molH2дёҺ2molI2еңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺпјҢз”ҹжҲҗHIеҲҶеӯҗж•°дёә2NA
ж•°зӣ®дёә0.1NA
C . 4.4gз”ұд№ҷйҶӣдёҺд№ҷй…ёд№ҷй…Ҝз»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«ж°§еҺҹеӯҗжҖ»ж•°дёә0.1NA
D . 1molH2дёҺ2molI2еңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺпјҢз”ҹжҲҗHIеҲҶеӯҗж•°дёә2NA
 дёҺ
дёҺ  з»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«дёӯеӯҗжҖ»ж•°дёәNA
B . 1L0.1mol/LNaAlO2жә¶ж¶Ідёӯеҗ«
з»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«дёӯеӯҗжҖ»ж•°дёәNA
B . 1L0.1mol/LNaAlO2жә¶ж¶Ідёӯеҗ«  ж•°зӣ®дёә0.1NA
C . 4.4gз”ұд№ҷйҶӣдёҺд№ҷй…ёд№ҷй…Ҝз»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«ж°§еҺҹеӯҗжҖ»ж•°дёә0.1NA
D . 1molH2дёҺ2molI2еңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺпјҢз”ҹжҲҗHIеҲҶеӯҗж•°дёә2NA
ж•°зӣ®дёә0.1NA
C . 4.4gз”ұд№ҷйҶӣдёҺд№ҷй…ёд№ҷй…Ҝз»„жҲҗзҡ„ж··еҗҲзү©дёӯеҗ«ж°§еҺҹеӯҗжҖ»ж•°дёә0.1NA
D . 1molH2дёҺ2molI2еңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺпјҢз”ҹжҲҗHIеҲҶеӯҗж•°дёә2NA
зҹӯе‘ЁжңҹйқһйҮ‘еұһе…ғзҙ XгҖҒYгҖҒZгҖҒWзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢеҹәжҖҒXеҺҹеӯҗзҡ„жңӘжҲҗеҜ№з”өеӯҗж•°жҳҜе…¶жүҖеңЁе‘ЁжңҹдёӯжңҖеӨҡзҡ„пјҢеҹәжҖҒWеҺҹеӯҗзҡ„з”өеӯҗжҖ»ж•°жҳҜе…¶жңҖй«ҳиғҪзә§з”өеӯҗж•°зҡ„4еҖҚгҖӮеӣӣз§Қе…ғзҙ дёҺXeе…ғзҙ з»„жҲҗзҡ„жҹҗеҢ–еҗҲзү©зҡ„з»“жһ„еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү

A . Wзҡ„еёёи§Ғж°§еҢ–зү©жҳҜй…ёжҖ§ж°§еҢ–зү©
B . жңҖз®ҖеҚ•ж°ўеҢ–зү©зҡ„жІёзӮ№пјҡZпјһYпјһX
C . ж°”жҖҒж°ўеҢ–зү©зҡ„иҝҳеҺҹжҖ§Wпјһ Z
D . Xе’ҢWзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„жө“жә¶ж¶ІйғҪе…·жңүејәж°§еҢ–жҖ§
34SeдёҺSдёәеҗҢдё»ж—Ҹе…ғзҙ гҖӮжңүе…іжҖ§иҙЁзҡ„жҜ”иҫғй”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . еҚҠеҫ„пјҡSeпјһS
B . жІёзӮ№пјҡH2OпјһH2Se
C . й…ёжҖ§пјҡH2SeO4пјһH2SO4
D . йқһйҮ‘еұһжҖ§пјҡClпјһSe
й»‘зҒ«иҚҜжҳҜдёӯеӣҪеҸӨд»ЈеӣӣеӨ§еҸ‘жҳҺд№ӢдёҖпјҢе…¶зҲҶзӮёеҺҹзҗҶдёә2KNO3+S+3C=K2S+N2вҶ‘+3CO2вҶ‘гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . жҜҸж¶ҲиҖ—0.1molSпјҢеҗҢж—¶з”ҹжҲҗ6.72LCO2
B . ж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„жҖ»зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ2
C . жҜҸз”ҹжҲҗ0.5molN2 пјҢ еҸҚеә”иҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёә6mol
D . иҜҘеҸҚеә”иҝҮзЁӢдёӯеҸӘжңүжһҒжҖ§й”®е’ҢзҰ»еӯҗй”®зҡ„еҪўжҲҗ
еӣһзӯ”дёӢеҲ—й—®йўҳ
-
пјҲ1пјү еҹәжҖҒж°§еҺҹеӯҗд»·еұӮз”өеӯҗзҡ„иҪЁйҒ“иЎЁзӨәејҸдёәгҖӮ
-
пјҲ2пјү д№ҷзӮ”зҡ„з”өеӯҗејҸдёәпјҢзӯүзү©иҙЁзҡ„йҮҸзҡ„д№ҷзӮ”е’Ңж°ҙеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү д№ҷйҶӣдёҺ银氨жә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
жңҖиҝ‘жӣҙж–°



