第一章 物质结构 元素周期律 知识点题库
某种原子的电子排布式为1s22s22p63s23p1,有关该原子的下列说法中正确的是( )
A . 该原子核内有13个中子
B . 该原子的简化电子排布式为[He]3s23p1
C . 该原子最外层有1个电子
D . 该原子第二能层上有8个电子
-
(1) 氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取杂化,NH4+中HNH键角比NH3中HNH键角大,原因是。
-
(2) Cu3N形成的晶体结构如图所示,N3-的配位数是。

-
(3) 常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有,其大小顺序是。
-
(4) NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是。
短周期主族元素X、Y、Z、W的原子序数依次增大,X.Z同主族,X、Y、Z能形成化合物Q,25℃时,0.01mol/LQ溶液的pH为12,Y、Z、W形成的一种化合物常用作生活中的消毒剂和漂白剂,下列说法正确的是( )
A . 原子半经: X<Y<Z<W
B . X、Y形成化合物分子中可能含有非极性键
C . Y与Z属于同一周期,与W属于同一主族
D . 四种元素中,W元素的非金属性最强
下列与化学键相关的叙述中正确的是( )
A . 含共价键的化合物一定是共价化合物
B . 离子化合物中一定含有离子键
C . 离子键是阴阳离子的静电吸引
D . 极性键与非极性键无法共存
元素周期表中短周期元素W、X、Y、Z、M原子序数依次增大,W的某种简单离子只有质子;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,其原子半径是同周期元素里原子半径最大的;Z元素离子半径在同周期中是最小的;W的单质在M的单质中燃烧伴有苍白色火焰。下列说法正确的是( )
A . 简单离子半径:M>Y>Z>X>W
B . 1molY的单质与足量的X单质完全反成,产物中离子总数定为1.5NA
C . Z的单质既能与Y的最高价氧化物对应的水化物发生反应放出气体,也能与M的最高价氧化物对应的水化物发生反应放出气体,且放出的气体体积都为33.6L(标况下)
D . W的单质与X、M的单质都能反应,且反应中W的单质都作氧化剂
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X、Y、Z原子最外层的电子数之和与W原子最外层的电子数相等,X的最低负价为-4,Y的周期数是族序数的3倍。下列说法正确的是()
A . 原子半径:Y>Z>X
B . Y的最高价氧化物对应的水化物的碱性比Z的弱
C . W的氧化物对应的水化物的酸性一定比X的强
D . W分别与X、Z形成的化合物所含的化学键类型相同
2016年IUPAC命名117号元素为Ts(中文名“  ”,tián),Ts的原子核外最外层电子数是7。下列说法错误的是( )
”,tián),Ts的原子核外最外层电子数是7。下列说法错误的是( )
A . Ts是第七周期第ⅦA族元素
B . Ts的同位素原子具有相同的电子数
C . Ts在同族元素中非金属性最弱
D . 中子数为176的Ts核素符号是 

A,B,C,D,E为短周期元素且原子序数依次増大,质子数之和为40。B、C同周期, A,D同主族, A,C能形成两种液态化合物A2C和A2C2, E的最高价氧化物的水化物呈两性。
-
(1) B元素在周期表中的位置为。
-
(2) 由A,C,D三种元素组成的化合物的电子式为。
-
(3) 废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式。
-
(4) 若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为。(氧化产物不污染环境)
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中错误的是( )

A . 每个N5+中含有35个质子和34个电子
B . 该离子中有非极性键和配位键
C . 该离子中含有4个π键
D . 与PCl4+互为等电子体
一种化合物Y2ZW3X可用作牙膏的添加剂,W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Z的最高价氧化物的水化物是三元酸,Y的原子半径是短周期主族元素中最大的,W与X的最外层电子数之和为13。下列说法错误的是( )
A . 简单氢化物的沸点:W>X
B . 离子半径:Y>W>X
C . Z的最高价氧化物可用作干燥剂
D . Y与X形成的化合物的水溶液呈碱性
下列叙述正确的是( )
A . 金属晶体的一个晶胞中所含的原子数:钾型=镁型<铜型
B . 在卤族元素(F、Cl、Br、I)的氢化物中,HF的沸点最低
C . CaH2、Na2O2晶体的阴、阳离子个数比分别为2∶1、1∶1
D . 晶体熔点:金刚石>食盐>干冰>冰
-
(1) 写出明矾的化学式,写出CaC2的电子式。
-
(2) N2H4·H2O分子中,非金属性最强的元素在周期表中的位置。
-
(3) H2O比H2S的相对分子质量小,但H2O的沸点远高于H2S,原因是。
-
(4) NH4Cl溶液呈酸性,用离子方程式表示其原因。
-
(5) 25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:。
-
(6) 铁在空气中发生吸氧腐蚀时的正极反应方程式:。
-
(7) 硫酸铜溶液通电时发生的化学反应方程式:。
-
(8) 写出向氯化铝溶液中滴加足量氨水的离子方程式。
下列说法一定正确的是( )
A . 分子晶体中都存在共价键
B . 当中心原子的配位数为6时,配合单元常呈八面体空间结构
C . SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D . 金属晶体的熔点都比分子晶体的熔点高
具有下列价电子数的原子,最难形成离子的是( )
A . L层6个
B . L层4个
C . M层2个
D . M层7个
下列有关C、N、S等非金属元素化合物的说法正确的是( )
A . NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
B . SO2具有漂白性可以使酸性高锰酸钾溶液褪色
C . 实验室可用NaOH溶液处理NO2和SO2废气
D . 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
前四周期主族元素X、Y、Z、W的原子序数依次增大,在元素周期表中X的原子半径最小,Y的原子次外层电子数是其最外层电子数的 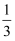 ,Z的单质可与冷水迅速反应产生X的单质,W与X同主族。下列叙述正确的是( )
,Z的单质可与冷水迅速反应产生X的单质,W与X同主族。下列叙述正确的是( )
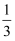 ,Z的单质可与冷水迅速反应产生X的单质,W与X同主族。下列叙述正确的是( )
,Z的单质可与冷水迅速反应产生X的单质,W与X同主族。下列叙述正确的是( )
A . 单质的还原性:Z>W
B . Y、Z的简单离子的核外电子排布相同
C . 化合物X2Y、Z2Y、ZX中化学键的类型相同
D . 原子半径:W>Y>Z
我国嫦娥五号探测器带回的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z的原子序数依次增大,四种元素最外层电子数之和为15,X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
A . 简单离子的半径大小顺序为W>Y>Z>X
B . Y元素最高价氧化物对应的水化物具有两性
C . 工业上均采用电解法制备Y和Z的单质
D . 四种元素的最高正价等于主族序数
一种有机合成中间体和活性封端剂的分子结构式如图所示。其中W、X、Y、Z的原子序数依次增大,X、Y同主族,W原子与X原子的质子数之和等于Z原子的最外层电子数。下列说法正确的是( )

A . 原子半径: B . 相同压强下单质的沸点:
B . 相同压强下单质的沸点: C . 最高价含氧酸酸性:
C . 最高价含氧酸酸性: D . W与X形成的化合物中只含极性键
D . W与X形成的化合物中只含极性键
 B . 相同压强下单质的沸点:
B . 相同压强下单质的沸点: C . 最高价含氧酸酸性:
C . 最高价含氧酸酸性: D . W与X形成的化合物中只含极性键
D . W与X形成的化合物中只含极性键
[化学-选修3:物质结构与性质]
CuaSnbSc属于三元化合物,是一种重要的半导体和非线性光学材料,具有杰出的热学、光学和机械等性质,因而备受人们的广泛关注。回答下列问题:
-
(1) CuaSnbSc中Cu元素有+1和+2两种价态,从结构上分析基态Cu+、Cu2+中更稳定,原因是;其中Cu2+可与CN-形成配离子[Cu(CN)4]2- , 1 mol该配离子中含有σ键的物质的量为mol.
-
(2) 该三元化合物的四方相晶体结构如图(a)所示,其化学式为。

-
(3) CuaSnbSc的四方相晶体结构中Cu+离子在晶胞中的配位数是,S原子的杂化类型是。
-
(4) 锡有白锡和灰锡两种单质,白锡晶体中锡原子为六方最密堆积,如图(b)所示,灰锡晶体的结构类似于金刚石,如图(c)所示,则白锡晶体和灰锡晶体晶胞中原子空间利用率之比为(保留三位有效数字),其中一个白锡晶胞中存在个四面体空隙(四面体空隙:由四个球体围成的空隙)。
盐在生产、生活中有广泛应用。下列盐的性质与用途具有对应关系的是( )
A . NaClO有强氧化性,可用于消毒杀菌
B . NaHSO3有还原性,可用于漂白纸浆
C . NaCl易溶于水,可用于工业电解制备钠
D . NaHCO3受热易分解,可用于制抗酸药物
最近更新



