第二章 化学反应与能量 知识点题库
-
(1) Ⅰ.配制0.50 mol·L-1 NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体g。
-
(2) 从下表中选择,称量NaOH固体所需要的仪器是(填字母)。
名称
托盘天平(带砝码)
小烧杯
坩埚钳
玻璃棒
药匙
量筒
仪器






序号
a
b
c
d
e
f
-
(3) Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
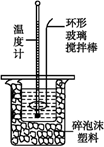
若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:。
-
(4) 取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
温度
实验次数
起始温度t1/℃
终止温度t2/℃
温度差平均值(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②用上述实验数值计算结果为kJ•mol-1 , 与57.3 kJ•mol-1有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
 O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B . 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C . 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D . 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B . 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C . 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D . 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量

-
(1) Ⅰ.用CO2生产甲醇
已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l)ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l)ΔH=kJ/mol。
-
(2) 将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

a,b两点化学反应速率分别用
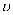 a、
a、 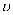 b表示,则
b表示,则 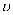 a
a 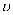 b(填“>”、“<”或“=”)。
b(填“>”、“<”或“=”)。 -
(3) 在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示:

下列说法正确的是________。
A . 该反应的正反应为放热反应 B . 压强大小关系为p1<p2<p3 C . M点对应的平衡常数K的值约为1.04×10-2 D . 在p2及512K时,图中N点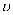 (正)<
(正)< 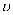 (逆)
(逆)
-
(4) Ⅱ.用CO生产甲醇
已知:CO(g)+2H2(g)⇌CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

T1和T2温度下的平衡常数大小关系是K1K2(填“>”、“<”或“=”)。
-
(5) Ⅲ.甲醇的应用
甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1 , 反应达到平衡时总压强为p2 , 则平衡时甲醇的转化率为。
 和
和  是环境污染性气体,可在
是环境污染性气体,可在  表面转化为无害气体,其总反应为
表面转化为无害气体,其总反应为  ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( )
,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( ) 
 为氧化剂
B .
为氧化剂
B .  C . 由图乙知该反应正反应的活化能小于逆反应的活化能
D . 为了实现转化,需不断向反应器中补充
C . 由图乙知该反应正反应的活化能小于逆反应的活化能
D . 为了实现转化,需不断向反应器中补充  和
和 
 +H2O⇌2
+H2O⇌2  +2H+。下列说法正确的是( )
+2H+。下列说法正确的是( )
 )=2υ逆(
)=2υ逆(  )
C . 平衡后混合物中各组分的物质的量浓度相等
D . 达到平衡后升温,正反应速率增大,逆反应速率减小
)
C . 平衡后混合物中各组分的物质的量浓度相等
D . 达到平衡后升温,正反应速率增大,逆反应速率减小

2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )

 )失去一个电子后形成的
)失去一个电子后形成的 结构较为稳定。一种铝胺电池工作原理示意如图。下列说法不正确的是( )
结构较为稳定。一种铝胺电池工作原理示意如图。下列说法不正确的是( )
 和
和 中Al原子的杂化方式相同
B . 放电时,负极的电极反应式为
中Al原子的杂化方式相同
B . 放电时,负极的电极反应式为 C . 充电时,
C . 充电时, 向铝电极移动
D . 理论上每生成1mol
向铝电极移动
D . 理论上每生成1mol  , 外电路通过1mol电子
, 外电路通过1mol电子

-
(1) CO2转化为甲醇有利于实现碳中和,该过程经历以下两步:
CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41kJ/mol
CO(g)+H2O(g) ΔH=+41kJ/molCO(g)+2H2(g)
 CH3OH(g) ΔH=-90kJ/mol
CH3OH(g) ΔH=-90kJ/mol①写出CO2(g)合成CH3OH(g) 总反应的热化学方程式:
②能说明反应CO2(g)合成CH3OH(g) 总反应已达平衡状态的是(填字母)。
A.CO2、H2、CH3OH分子数之比为1:3:1的状态
B.在恒温恒容的容器中,混合气体的平均摩尔质量保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的密度不再变化
E.单位时间内,每断裂2个C=O键,同时断裂3个O-H键
③在一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2 , 发生CO2合成CH3OH的总反应,测得10min达到平衡时氢气的平均速率为0.12mol/(L·min),则该反应的平衡常数为(保留一位小数)。该反应中v正=k正•c(CO2)•c3(H2),v逆=k逆•c(CH3OH)•c(H2O),其中k正、k逆为速率常数,仅与温度有关,则当反应过程中CO2的物质的量为0.5mol时,v正:v逆=。
-
(2) CO2催化加氢生成乙烯和也是CO2的热点研究领域
2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ∆H<0。
C2H4(g)+4H2O(g) ∆H<0。①写出实验室制备乙烯的化学方程式:
②达到平衡后,欲增加乙烯的产率,并提高反应的速率,可采取的措施(写出其中符合条件的一种)
③CO2催化加氢合成乙烯往往伴随着副反应,生成低碳烃,在一定的温度和压强下,为提高乙烯选择性,应当
④如图所示,关闭活塞,向甲乙两个密闭容器分别充入1molCO2和3molH2 , 发生反应CO2催化加氢生成乙烯,起始温度体积相同(T1℃、4L密闭容器),达到平衡时,乙的容器容积为2.8L,则平衡时甲容器中CO2的物质的量0.2mol(填“大于、小于、等于、无法确定”)

 HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始
HCHO(g) +H2O(g) ,达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入2molH2时,容器内气体的总压强为1.2p kPa。下列说法错误的是( )
的关系如图所示。已知:初始加入2molH2时,容器内气体的总压强为1.2p kPa。下列说法错误的是( )
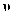 (H2)=0.1 mol·L-1·min-1
B . 随
(H2)=0.1 mol·L-1·min-1
B . 随 增大, HCHO的平衡压强不断增大
C . b点时反应的平衡常数Kp =
增大, HCHO的平衡压强不断增大
C . b点时反应的平衡常数Kp = D . c点时,再加入CO2(g)和H2O(g) ,使二者分压均增大0.2p kPa,平衡正向移动
D . c点时,再加入CO2(g)和H2O(g) ,使二者分压均增大0.2p kPa,平衡正向移动

 C . 用装置丙在铁制品表面镀铜
D . 用装置丁将
C . 用装置丙在铁制品表面镀铜
D . 用装置丁将 溶液蒸干制得无水
溶液蒸干制得无水
 2NH3(g)。反应过程中的部分数据如表所示,下列说法正确的是( )
2NH3(g)。反应过程中的部分数据如表所示,下列说法正确的是( )
| n(N2) | n(H2) | n(NH)3 |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
 既是一种重要的能源,也是一种重要的化工原料。
既是一种重要的能源,也是一种重要的化工原料。
-
(1) 甲烷分子的空间构型为。
-
(2) 如图是某同学利用注射器设计的简易实验装置。甲管中注入10mLCH4 , 同温、同压下乙管中注入50mL
 , 将乙管气体全部推入甲管中,用日光照射一段时间,气体在甲管中反应。
, 将乙管气体全部推入甲管中,用日光照射一段时间,气体在甲管中反应。
①某同学预测的实验现象:a.气体最终变为无色;b.反应过程中,甲管活塞向内移动;c.甲管内壁有油珠;d.产生火花。其中正确的是(填字母,下同)。
②实验结束后,甲管中剩余气体最宜选用下列试剂吸收。
A.水 B.氢氧化钠溶液 C.硝酸银溶液 D.饱和食盐水
③反应结束后,将甲管中的物质推入盛有适量
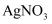 溶液的试管中,振荡后静置,可观察到,再向其中滴加几滴石蕊试液,又观察到。
溶液的试管中,振荡后静置,可观察到,再向其中滴加几滴石蕊试液,又观察到。 -
(3) 甲烷可直接应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图所示。
的固体氧化物为电解质,其工作原理如图所示。
①外电路电子移动方向为(填“a→b”或“b→a”)。
②a极的电极反应式为。
③若该燃料电池消耗空气5.6L(标准状况下),则理论上消耗甲烷mol(假设空气中
 体积分数为20%)。
体积分数为20%)。
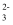 +6H2O。则下列有关说法错误的是( )
+6H2O。则下列有关说法错误的是( )
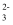 +6H2O
D . 每转移0.6 mol电子,则消耗氧气的体积为3.36L
+6H2O
D . 每转移0.6 mol电子,则消耗氧气的体积为3.36L



