课题3 纯碱的生产 知识点题库
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为 ;
②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS);
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
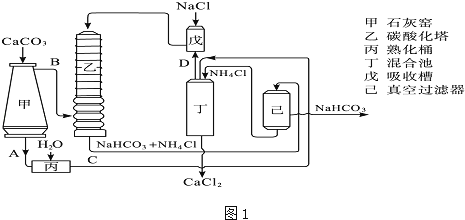
①图中的中间产物C是 ,D是 (写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法是对氨碱法的改进,其优点是 ;
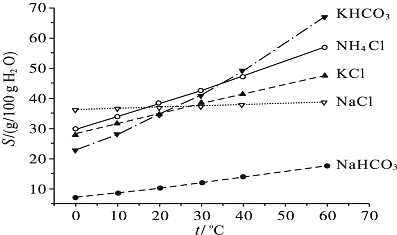
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合如图2的溶解度(S)随温度变化曲线,分析说明是否可行? .
化学与生产、生活密切相关.下列与化学有关的事实及其相关化学方程式的书写都正确的是( )
选项 | 事实 | 化学方程式 |
A | 常温下,可用铝制容器盛放浓硝酸 | A l+3HNO3(浓)=Al(OH)3+3NO2↑ |
B | 可用生石灰做工业废气脱硫酸 | 2CaO+2SO2+O2=2CaSO4 |
C | 电解MgCl2溶液冶炼Mg | MgCl2 |
D | 侯德榜用饱和食盐水、氨水、CO2制备纯碱 | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
 Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
 制备氨气
B .
制备氨气
B . 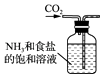 制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D .  灼烧NaHCO3
灼烧NaHCO3
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水;
③以尿素为原料生产三聚氰胺的原理是:6CO(NH2)2  C3N6H6+6NH3+3CO2
C3N6H6+6NH3+3CO2
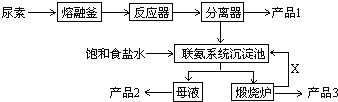
请回答:
-
(1) 尿素是一种常用含氮量最高的化肥,其氮元素的质量百分数为,在实验室使其熔化的容器名称叫.
-
(2) 写出各主要成分的化学式:产品2、X;
-
(3) 联氨系统沉淀池中发生的化学反应方程式为.
-
(4) 工业上合成尿素的化学反应方程式为(反应条件可以不写).
-
(5) 为了使母液中析出更多的产品2,常用的方法是
A.加入固体NaCl B.加入固体NaHCO3 C.通入CO2气体 D.通入NH3
-
(6) 若生产过程中有4%的尿素损耗,每吨尿素可生产三聚氰胺吨.(精确到0.001)
 B .
B .  C .
C . 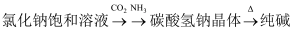 D .
D . 
①NH3+CO2+H2O=NH4HCO3;
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
③2NaHCO3=Na2CO3+CO2↑+H2O。
已知:NH3 是无色有强烈刺激性气味的碱性气体,极易溶于水。
-
(1) Ⅰ.原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是。
a 碳酸氢钠难溶于水 b 碳酸氢钠受热易分解 c 碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
-
(2) Ⅱ.实验探究
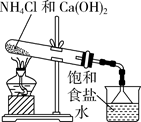
一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

回答下列有关问题:
a.乙装置中的试剂是;该试剂的目的:
b.丁装置中稀硫酸的作用是;
c.实验结束后,分离出 NaHCO3 晶体的操作是(填分离操作的名称)。

资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
|
物质 |
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
|
20℃溶解度/g |
36.0 |
21.7 |
9.6 |
37.2 |
-
(1) 煅烧炉中反应的化学方程式是,物质X是(填化学式)。
-
(2) 下列说法正确的是______(填字母)。A . 沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小 B . 滤液中主要含有NaCl、Na2CO3和NH4Cl C . 设计循环的目的是提高原料的利用率
-
(3) 工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是。
| 选项 | 化学工业 | 措施 | 目的 |
| A | 合成氨 | 500℃左右 | 防止催化剂中毒 |
| B | 石油化工 | 裂化 | 提高轻质油的产量 |
| C | 工业制硫酸 | V2O5催化 | 提高SO2的转化率 |
| D | 侯氏制碱 | 先通CO2 | 有利于CO2充分吸收 |
| 选项 | A. | B. | C. | D. |
| 实验操作 | | | | |
| 实验目的 | 制取氨气将其溶于饱和食盐水 | 用碳酸钠与稀硫酸制二氧化碳 | 过滤获得碳酸钠晶体 | 蒸发浓缩氯化铵溶液 |
① 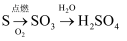
② 
③饱和  溶液
溶液 
④ 
⑤ 
-
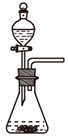
(1) 某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。其中一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

①乙装置中的试剂是填名称。
②实验结束后,分离出NaHCO3晶体的操作是。
③写出丙装置发生主要化学方程式。
-
(2) 另一位同学用图中成装置其他装置未画出进行实验。
①实验时,须先从管通入气体。
②有同学建议在戊装置的b管下端连接己装置,理由是。
③产品制备

若在煅烧炉中反应的时间较短,NaHCO3将分解不完全。欲测定某份煅烧了一段时间的样品的组成及原NaHCO3的分解率,称取一定量样品完全溶于水制成溶液,然后向此溶液中缓慢滴加稀盐酸,并不断搅拌。溶液中有关离子的物质的量随盐酸加入的变化如图所示,则曲线a、d对应的离子分别是、填离子符号,原NaHCO3的分解率为。

 D . NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性:SO
D . NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性:SO +H++OH-+Ba2+=BaSO4↓+H2O
+H++OH-+Ba2+=BaSO4↓+H2O
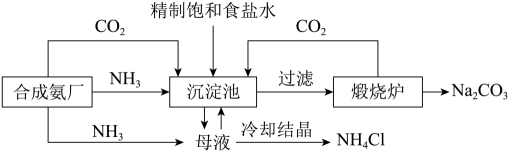
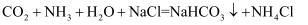 B . 吸收
B . 吸收 可使母液中的
可使母液中的 转化为
转化为 , 以提高
, 以提高 纯度
C . 该过程充分利用了合成氨工业提供的
纯度
C . 该过程充分利用了合成氨工业提供的 和
和 D . 向饱和食盐水中先通
D . 向饱和食盐水中先通 , 再通
, 再通 , 更有利于
, 更有利于 析出
析出
 Mg+Cl2↑
Mg+Cl2↑