课题3 纯碱的生产 知识点题库
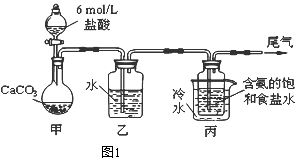
(1)装置乙的作用是 .为防止污染空气,尾气中含有的 需要进行吸收处理.
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、 、 .NaHCO3转化为Na2CO3的化学方程式为 .
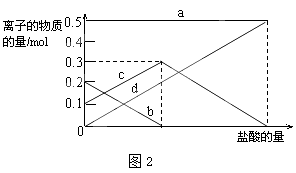
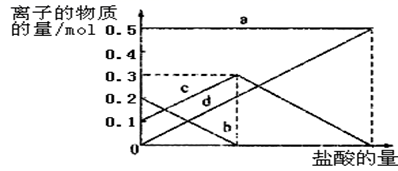
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3样品的组成进行了以下探究.取加热了t1 min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 .
(4)若取21.0g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8g.如果把此剩余固体全部加入到200mL 2mol•L﹣1的盐酸中则充分反应后溶液中H+的物质的量浓度为 (设溶液体积变化忽略不计).
2NaHCO3═Na2CO3+CO2↑+H2O↑ ②

(1)操作Ⅰ、Ⅱ可否颠倒?答: (填“能”或“不能”);操作Ⅲ的名称是 .
(2)写出向晶体X的水溶液中滴加NaOH溶液时发生反应的离子方程式: .
(3)在实验室反应②可在如图2装置中进行,该装置可进行多个化学反应,如实验室制取少量氧气也可利用该装置,请再写出一种利用该装置制取的常见气体的名称.答: .
-
(1) 在上述反应的反应物和生成物中,属于非电解质分子的电子式为.过量该物质与偏铝酸钠溶液反应的离子方程式为.
-
(2) 反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是(选填编号).
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
-
(3) 反应物中某些元素处于同一周期.它们最高价氧化物对应的水化物之间发生反应的离子方程式为.
-
(4) Na2CO3俗称纯碱,属于化合物(填离子“离子”、“共价”).工业上侯氏制碱法的原料是.
-
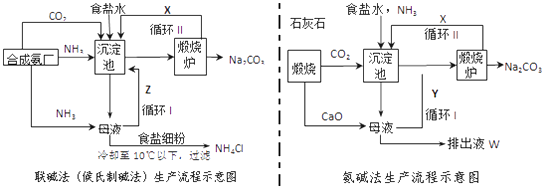
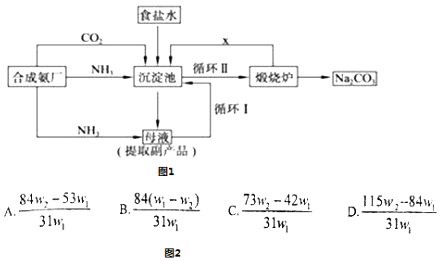
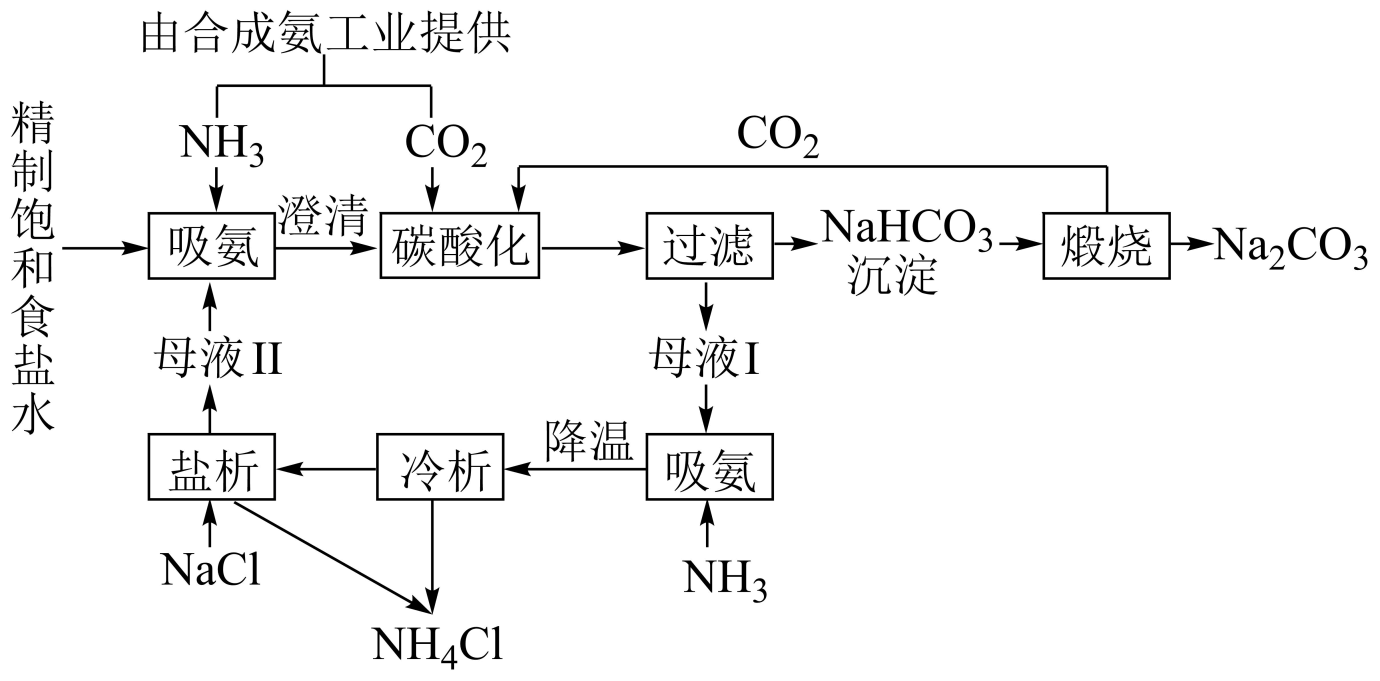
(1) 我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:

①向饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是
②从生产流程图可知,可循环利用的物质是
③写出沉淀池中、煅烧炉中反应的化学方程式
-
(2) 如何用CO2和50mL 2mol•L﹣1NaOH溶液制取50mL 1mol•L﹣1Na2CO3溶液?
①写出简要的实验步骤
②写出有关反应的化学方程式.
-
(1) 沉淀池中发生反应的化学方程式为;
-
(2) X是,Y是(填化学式);
-
(3) 从理论上分析,在氨碱法生产过程中(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为;
-
(4) 根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是;
a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
-
(5) 相比于氨碱法,指出联碱法的一项优点.
-
(1) 合成氨工业生产中所用的α﹣Fe催化剂的主要成分是FeO和Fe2O3 , 若某α﹣Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为;
-
(2) 向饱和NaCl溶液中先通入气体,效果更好.反应制得NaHCO3沉淀和NH4Cl溶液的化学程式为
-
(3) 索尔维制碱法除了得到纯碱外,还会产生一种废渣.侯氏制碱法在此工业上改进,不再使用CaCO3制备CO2 , 而是在制备NH3的过程中制得CO2 , 则侯氏制碱法在得到纯碱的同时还制得了,此物质在农业上的用途是.
请回答下列问题:
-
(1) 往饱和食盐水中通入足量的NH3、CO2 , 先通.
-
(2) 从生产流程图可知,可循环的物质是.
-
(3) 写出生产流程中的化学方程式.
-
(4) 为了检验含有NaHCO3杂质的Na2CO3产品的纯度,现将W1g产品加热到恒重,其质量为W2g,则该产品的纯度(质量分数)是图2中的.
①金属钠投入FeCl3溶液中
②少量Ca(OH)2投入过量NaHCO3溶液中
③向饱和Na2CO3溶液中通入足量CO2
④向AlCl3溶液中滴入NaHCO3溶液
⑤过量NaOH溶液和明矾溶液混合

完成下列填空:
-
(1) 粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A,B。
-
(2) 碳酸化后过滤,滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
-
(3) 该工艺流程中可回收再利用的物质是。
-
(4) 产品纯碱中含有碳酸氢钠,如果取m1kg纯碱加热分解后剩余固体质量为m2kg,纯碱中碳酸氢钠的质量分数可表示为:。
-
(1) Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。
-
(2) 处理母液的方法:向母液中加入石灰乳,反应的化学方程式为,目的是使循环利用。
-
(3) Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3 , 然后再将NaHCO3制成Na2CO3。
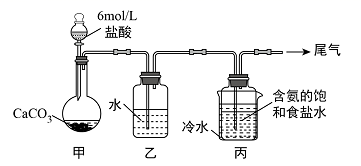
装置丙中冷水的作用是;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、洗涤、灼烧。
-
(4) 若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了以下探究。取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是mol、mol。
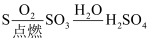 B . 淀粉
B . 淀粉  C .
C .  D . 饱和NaCl溶液
D . 饱和NaCl溶液  NaHCO3晶体
NaHCO3晶体
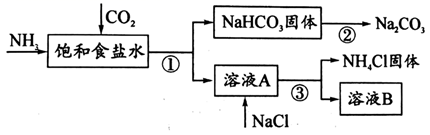
-
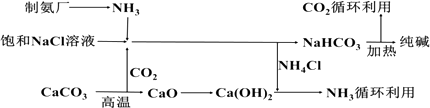
(1) ①~③所涉及的操作方法中,包含过滤的是 (填序号)。
-
(2) 根据上图,将化学方程式补充完整: NH3 + CO2 ++ = NaHCO3↓+ NH4Cl
-
(3) 煅烧NaHCO3固体的化学方程式是。
-
(4) 下列说法中,正确的是_____ (填字母)。A . CO2可循环使用 B . NH4Cl副产物可用作肥料 C . 溶液B中一定含有Na+、NH
 、Cl-
、Cl-
-
(5) 同学们将Na2CO3和NaHCO3固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案
预测现象
预测依据
操作1:向2 mLNa2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
有白色沉淀
Na2CO3溶液中的CO
 浓度较大,能与CaCl2发生反应(写离子方程式)
浓度较大,能与CaCl2发生反应(写离子方程式)操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
无白色沉淀
NaHCO3溶液中的CO
 浓度很小,不能与CaCl2反应
浓度很小,不能与CaCl2反应
下列说法不正确的是( )

-
(1) ①~③所涉及的操作方法中,包含过滤的是(填序号)。
-
(2) 根据上图,写出①中发生反应的化学方程式:。
-
(3) 下列说法中,正确的是(填字母)。
a.
 可循环使用
可循环使用b.副产物
 可用作肥料
可用作肥料c.溶液B中一定含有
 、
、 、
、
-
(4) 除去
 粉末中混有的少量小苏打的方法是,所涉及的反应的化学方程式为。
粉末中混有的少量小苏打的方法是,所涉及的反应的化学方程式为。
-
(5) 若制出的纯碱样品中含有的杂质只有NaCl。
①检验用该纯碱样品配制的溶液中含有
 的方法是。
的方法是。②向m g纯碱样品中加入足量的
 溶液,沉淀经过滤、洗涤、干燥,称其质量为b g。则该纯碱样品的纯度(质量分数)为(用m、b 来表示)。
溶液,沉淀经过滤、洗涤、干燥,称其质量为b g。则该纯碱样品的纯度(质量分数)为(用m、b 来表示)。
-
(1) 早期人们常用碱液来吸收二氧化碳,生产各类碳酸盐产品。我国科学家侯德榜先生首创的“向饱和NaCl溶液中先后通入过量的氨气和
 制得小苏打和氯化铵,再通过煅烧小。苏打生成纯碱”,称为“侯氏制碱法”。请写出生成小苏打的化学反应方程式。
制得小苏打和氯化铵,再通过煅烧小。苏打生成纯碱”,称为“侯氏制碱法”。请写出生成小苏打的化学反应方程式。
-
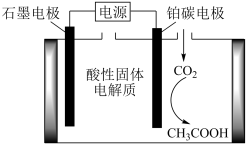
(2) 2021年我国科学家在国际上首先实现了从二氧化碳到淀粉的全人工合成,其原理是利用新型电化学催化装置实现二氧化碳转化为醋酸(如图所示),再经过生物发酵技术转化为淀粉。该装置中阴极的电极反应式为。
-
(3) 我国科学家王亮在
 合成燃料
合成燃料 的催化剂选择方面取得了重大突破,其反应原理如下:
的催化剂选择方面取得了重大突破,其反应原理如下:
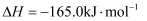 , T℃时,将
, T℃时,将 和
和 充入体积为2L的恒容密闭容器中发生如上反应,10min后反应达到平衡,此时容器内的压强变为起始的
充入体积为2L的恒容密闭容器中发生如上反应,10min后反应达到平衡,此时容器内的压强变为起始的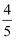 。
。①T℃时,该反应的平衡常数
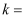 ,0~10min内
,0~10min内 的平均反应速率
的平均反应速率 ;
;②下列情形能表示该反应达到平衡状态的有(填正确答案标号);
A.容器内混合气体的平均摩尔质量不再改变
B.容器内气体的密度不再改变
C.
 的体积分数保持不变
的体积分数保持不变D.
 的值保持不变
的值保持不变E.
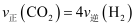
③在T℃时,为了提高
 的转化率可以采取的措施有:等比例增加
的转化率可以采取的措施有:等比例增加 和
和 的物质的量或(任填一种)。
的物质的量或(任填一种)。



