第二节 影响化学反应速率的因素 知识点题库
实例 | 影响速率的因素 | 如何影响 |
粉状的碳酸钙与盐酸反应比块状的碳酸钙反应快 | 反应物颗粒的大小(或 反应物接触面积的大小) | 反应物的颗粒越小(或 反应物接触面积越大),反应速率越快 |
夏天食物易变质 | ||
硫在氧气中比在空气中燃烧快 | ||
双氧水与二氧化锰混合可快速产生氧气 | ||
工业合成氨通常要在高压下进行 |
 CuSO4+H2↑
C . 某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D . 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
CuSO4+H2↑
C . 某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D . 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
-
(1) 前2s内用FeCl2表示的平均反应速率为
-
(2) 后4s内用HCl表示的平均反应速率为
-
(3) 前2s与后4s比较,反应速率 较快,其原因可能.
选项 | 反应 温度 | 反 应 物 | H2O | |||
Na2S2O3 | H2SO4 | |||||
t(℃) | V(mL) | c(mol×L-1) | V(mL) | c(mol×L-1) | V(mL) | |
A | 10 | 5 | 0.1 | 10 | 0.1 | 10 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 30 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 35 |
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1mol•L-1的A、B溶液各10mL ④0.3 mol•L-1的A、B溶液各50mL
四者反应速率大小关系是( )

-
(1) 提高“酸浸”反应速率的措施有适当增加硫酸的浓度和。
-
(2) “浸渣1”中除铋的化合物外,还有的物质是(填化学式)
-
(3) “浸液1”中加入过量锌粉,作用是;反应完毕后,过滤,从滤液中得到ZnSO4·7H2O晶体的操作有、、过滤、洗涤、干燥。
-
(4) “浸铜”时,有单质硫生成,写出生成硫的离子方程式
-
(5) “浸铋”时,在室温和液固比(盐酸、NaCl溶液组成的混合溶液的质量与“浸渣2”的质量的比值)固定的条件下,c(HCl)=1 mol·L-1时,铋的浸出率和Cl-浓度的关系如下图所示,其中NaCl的作用是,若升高温度,铋的浸出率反而下降,其可能的原因是。

-
(6) “沉铋”时需要控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为

-
(1) Fe、Co、Ni在周期表中的位置为,基态Fe原子的电子排布式为。
-
(2) CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA , 则CoO晶体的密度为g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。

-
(3) Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:。
-
(4) 95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当
 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为。 
-
(1) 新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。

①整个过程中 FeO 的作用是;
②写出 CO2 转化为炭黑的总反应化学方程式。
-
(2) 由CO2 合成甲醇是CO2资源化利用的重要方法。
研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH ①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
②研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH0(填“>”或“<”),其依据是。

-
(3) 工业用二氧化碳加氢可合成乙醇:
 保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比  的关系如图所示。
的关系如图所示。 
①该反应平衡常数的表达式为。
②投料比m1、m2、m3由大到小的顺序为 。


①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
①恒温时,增大压强,化学反应速率一定加快
②其他条件不变,温度越高化学反应速率越快
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量
④  的反应速率一定比
的反应速率一定比  的反应速率大
的反应速率大
⑤有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加单位体积内活化分子数,从而使反应速率增大
⑥增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多
-
(1) I.联氨(N2H4)是火箭燃料,有专家设计了一种联氨环保电池,其工作原理如图所示。回答下列问题:

联氨的电子式为。
-
(2) c口通入,N极为电源的极,N极反应式。
-
(3) M极反应式为,电极附近碱性(填增强、减弱或不变)。
-
(4) Ⅱ.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是____。A . 将肉类等食品进行低温冷藏,能使其永远不会腐败变质 B . 在化学工业中,催化剂不参与反应,但能增大反应速率 C . 自然条件下,夏天面粉发酵速度与冬天面粉发酵速度相差不大 D . 茶叶等包装中加入的还原性铁粉能延长茶叶储存时间
-
(5) 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是____。A . 对该反应体系加热 B . 向溶液中滴加浓硝酸,以增大氢离子浓度 C . 滴加少量CuSO4溶液 D . 改用铁粉 E . 改用浓度为98.3%的浓硫酸
-
(6) 反应4A(s)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。对此反应速率的表示正确的是____。A . 用A表示的反应速率是0.4mol·(L·min)-1 B . 分别用B、 C . D表示反应的速率,其比是3:2:1C.在2min末的反应速率,用B表示是0.3mol·(L·min)-1 D . 在这2min内用B和C表示的反应速率的值都是逐渐减小的
-
(7) Ⅲ.化学反应伴随着能量变化是化学反应的基本特征之一
下列物质发生的变化中属于吸热反应的是。
①氢氧化钡与氯化铵混合后搅拌 ②盐酸滴入碳酸氢钠
③炽热的碳与二氧化碳 ④硝酸铵固体投入水中
-
(8) 某同学进行如下实验,以检验化学反应中的能量变化。回答问题:
实验中发现,反应后温度计示数升高。由此判断铝条与盐酸的反应是(填“吸”或“放”)热反应。其能量变化(填“能”或“不能”)用如图表示。


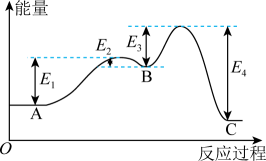
 B . 两步反应均为放热反应
C . 若反应使用合适的催化剂,可以降低活化能提高反应速率,同时平衡正向移动
D . A→B形成化学键释放的能量大于破坏化学键吸收的能量
B . 两步反应均为放热反应
C . 若反应使用合适的催化剂,可以降低活化能提高反应速率,同时平衡正向移动
D . A→B形成化学键释放的能量大于破坏化学键吸收的能量



