课题一 实验化学起步 知识点题库
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C . 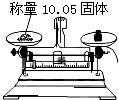 D .
D . 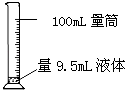
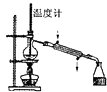 制蒸馏水
C .
制蒸馏水
C . 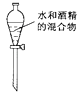 分离水和酒精
D .
分离水和酒精
D . 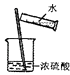 稀释浓硫酸
稀释浓硫酸
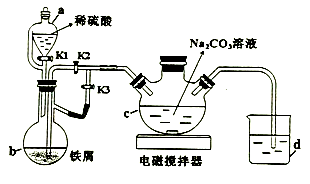
-
(1) a的名称为。
-
(2) 打开a中K1、K3 , 关闭K2 , 一段时间后,关闭K3 , 打开K2。在(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有、。(写2条)
-
(3) 将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因。
-
(4) 将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是。
-
(5) 用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为,此法产品纯度更高,原因是。
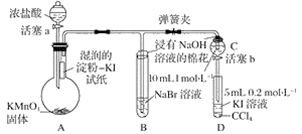
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
-
(1) 验证氯气的氧化性强于碘的实验现象是。
-
(2) B中溶液发生反应的离子方程式是。
-
(3) 为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是。
-
(4) 过程Ⅲ实验的目的是。
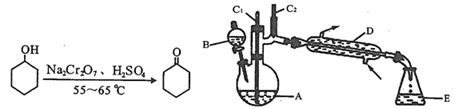
有关物质的物理性质见下表。
| 物质 | 沸点(℃) | 密度(g·cm-3 , 20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
| 环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
-
(1) 装置D的名称为。
-
(2) 酸性Na2Cr2O7溶液氧化环己醇反应的
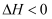 ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。 ①滴加酸性Na2Cr2O7溶液的操作为;
②蒸馏不能分离环己酮和水的原因是。
-
(3) 环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是;
②B中水层用乙醚萃取的目的是;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有,操作d中,加入NaCl固体的作用是。
-
(4) 恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为。(计算结果精确到0.1%)

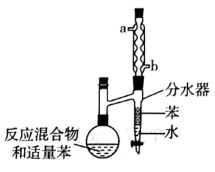
| 选项 | A | B | C | D |
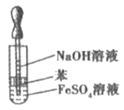
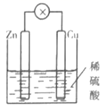
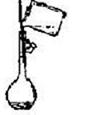
| 实验目的 | 分离乙醇与水 | 抽取并观察Fe(OH)2沉淀 | 比较Zn与Cu的活泼性 | 抽取少量的铁 |
| 实验装置 | | | | |
 B .
B . 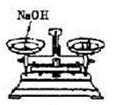 C .
C . 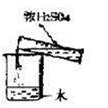 D .
D . 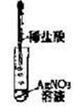
a.量筒b.容量瓶c.滴定管d.托盘天平e.温度计
-
(1) 无“0”刻度的是(填字母)。
-
(2) 下列操作合理的是___________(填字母)。A . 用25mL碱式滴定管量取20.00mLNaHCO3溶液 B . 用托盘天平准确称量10.20g碳酸钠固体 C . 用100mL量筒量取3.2mL浓硫酸 D . 用500mL容量瓶配制1mol·L-1的氢氧化钠溶液495.5mL
-
(3) 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,滴加2滴酚酞作指示剂,边滴边摇动锥形瓶,直到,这表示已经到达滴定终点。记录盐酸的终读数,重复滴定3次。若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为mL。

-
(4) 某学生根据三次实验分别记录有关数据如下表:
滴定次数
待测氢氧化钠溶液的体积/mL
0.1000mol·L-1盐酸的体积/mL
滴定前刻度
滴定后刻度
溶液体积
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=。
-
(5) 由于不正确操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。A . 中和滴定到达终点时俯视滴定管内液面读数 B . 碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 C . 酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 D . 把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后装入滴定管进行滴定
-
(1) 历史最久,技术和工艺也比较成熟,但成本较高的海水淡化方法是。
-
(2) 步骤1中,粗盐中含有
 、
、 、
、 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)
A . ①②③④ B . ②③④① C . ④③②① D . ③②④①
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)
A . ①②③④ B . ②③④① C . ④③②① D . ③②④① -
(3) 海水提溴工艺中热空气吹出
 , 利用了溴的性质;吹出的溴蒸气在吸收塔中被
, 利用了溴的性质;吹出的溴蒸气在吸收塔中被 和水吸收,写出离子方程式。
和水吸收,写出离子方程式。
-
(4) 为了把海水中
 转化为
转化为 , 从原料来源及经济效益角度考虑,最好选用。
, 从原料来源及经济效益角度考虑,最好选用。a.氨水 b.氢氧化钙 c.氢氧化钠
-
(5) 写出无水氯化镁制备Mg的化学方程式:。
-
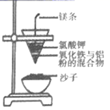
(6) 在实验室模拟海带提碘的实验过程。灼烧海带时,会用到的主要仪器有酒精灯、三脚架、玻璃棒、。