第三单元 物质的检测 知识点题库
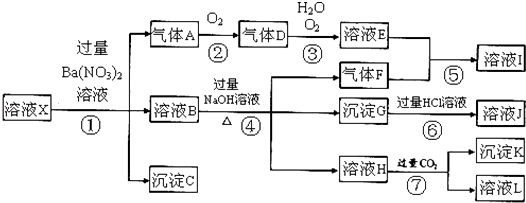
请回答下列问题:
-
(1) 由强酸性条件即可判断溶液X中一定不存在的离子有:
-
(2) 溶液X中,关于NO3ˉ的判断一定正确的是;a.一定有 b.一定没有 c.可能有
-
(3) 产生气体A的离子方程式为;
-
(4) 转化⑥发生反应的现象为;
-
(5) 转化④中产生H的离子方程式为;
-
(6) 若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
-
(7) 对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是.
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液.

-
(1) 写出四种单质的化学式
A B C D
-
(2) 写出H+B→G的离子方程式;
-
(3) 写出G+I→H+D+E的化学方程式;
-
(4) 某工厂用B制漂白粉.
①写出制漂白粉的化学方程式.
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为:),静置.待完全反应后,用0.2mol•L﹣1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL.则该漂白粉中有效成分的质量分数为保留到小数点后两位).
-
(1) 若A为金属铝,B为氧化铁,该反应的一种用途是。
-
(2) 若A是一种能使紫色石蕊试液变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为。
-
(3) 若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的离子反应方程式为。
-
(4) 若A是一种酸式盐,可作为食品制作过程中的膨松剂,A、
B、D溶于水时均呈碱性,则该反应的离子反应方程式为。
①取少量样品加足量水充分混合,观察到气体产生,反应后仍有部分固体未溶解,过滤;
②滤渣加入足量NaOH溶液,滤渣溶解;
③滤液中加足量稀硝酸酸化,再加几滴AgNO3溶液,产生白色沉淀。该白色粉末可能是()
-
(1) 理论计算该盐酸的物质的量浓度为:。
-
(2) 若用甲基橙作指示剂,达到满定终点时的现象是。
-
(3) 现有三种浓度的标准NaOH溶液,你认为最合适的是下列第种。
①5.00mol·L-1 ②0.500mol·L-1 ③0.0500mol·L-1
-
(4) 若采用上述最合适浓度的标准NaOH溶液满定,滴定时实验数据列表如下:
实验次数编号
待测盐酸体积(mL)
滴入NaOH溶液体积(mL)
①
10.00
8.48
②
10.00
8.52
③
10.00
8.00
求这种待测稀盐酸的物质的量浓度c(HCl)=。
-
(5) 在滴定操作过程中,以下各项操作使测定值偏高的有:
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定前平视,滴定终了俯视
④看到颜色变化后立即读数
⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
 B . 用装置乙吸收NH3制取Al(OH)3
B . 用装置乙吸收NH3制取Al(OH)3  C . 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌
C . 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌  D . 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl
D . 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl 
-
(1) 目前加碘食盐中,不用KI的主要原因是。
-
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为。
-
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数 (写出计算过程)。
 ,
,  在溶液中被氧化时一般生成
在溶液中被氧化时一般生成  。有一无色未知溶液可能含有K+、Fe2+、
。有一无色未知溶液可能含有K+、Fe2+、  、I-、
、I-、  中的一种或者几种,现做以下实验:①取部分溶液加入少量溴水,振荡,溶液呈无色;
中的一种或者几种,现做以下实验:①取部分溶液加入少量溴水,振荡,溶液呈无色; ②向①的溶液中加入过量氯化钡溶液,产生白色沉淀,再加过量稀硝酸沉淀不溶解;
③取少量②的溶液滴入足量AgNO3溶液,有沉淀生成。
下列关于无色溶液组成的判断正确的是:( )
 ,肯定不含Fe2+、I- , 可能含有K+、
,肯定不含Fe2+、I- , 可能含有K+、  B . 肯定含有
B . 肯定含有  ,肯定不含Fe2+、I- , 可能含有K+、
,肯定不含Fe2+、I- , 可能含有K+、  C . 肯定含有K+、
C . 肯定含有K+、  ,肯定不含Fe2+ , 可能含有
,肯定不含Fe2+ , 可能含有  、I-
D . 肯定含有
、I-
D . 肯定含有  、
、  ,肯定不含Fe2+、I- , 可能含有K+
,肯定不含Fe2+、I- , 可能含有K+
 2Na+Cl2↑。已知B是黄绿色气体,物质A、B、C、D、E、F有如图所示转化关系:
2Na+Cl2↑。已知B是黄绿色气体,物质A、B、C、D、E、F有如图所示转化关系: 
-
(1) A→C的离子反应方程式:。
-
(2) 写出E与F反应的化学方程式:。
-
(3) A在空气中加热生成的物质的颜色为。
-
(4) B→D反应中,当消耗铁的质量112g时,此时转移的电子的物质的量为mol
-
(5) B物质还可以制备漂白粉,漂白粉的有效成分是,漂白粉若保存不当,长期露置空气中,会导致漂白作用减弱,甚至失效,其原因是(用化学方程式表示)。
 、
、  、
、  、
、  这四种无色溶液区分开的一种试剂是(必要时可加热)( )
这四种无色溶液区分开的一种试剂是(必要时可加热)( )
 溶液
B .
溶液
B .  溶液
C .
溶液
C .  溶液
D .
溶液
D .  溶液
溶液
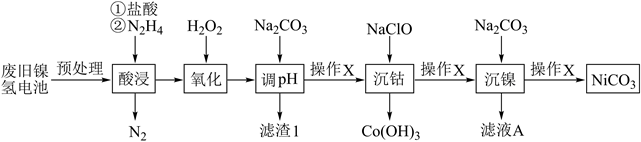
-
(1) N2H4的电子式是;“酸浸”中,加入N2H4的主要作用是。
-
(2) “氧化”过程中与Fe2+有关的离子方程式是,滤渣1主要成分是弱碱,其化学式是。
-
(3) 已知
 =8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)
=8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)
-
(4) 滤液A的主要溶质是;操作X是
-
(5) 用滴定法测定NiCO3产品中镍元素含量。取2.500g样品,酸溶后配成250mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定。
已知:①Ni2++H2Y2-=[NiY]2-+2H+
②紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的现象是。
②如果紫脲酸胺滴入过多,终点延迟,则会导致。
 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为 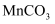 ,含有
,含有  等杂质)制备,部分工艺流程如下:
等杂质)制备,部分工艺流程如下: 
相关金属离子生成氢氧化物沉淀的  如表(开始沉淀的
如表(开始沉淀的  按离子浓度为
按离子浓度为  计算):
计算):
| 金属离子 | | | | | |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
-
(1) “氧化”时发生反应的离子方程式为;
-
(2) “调pH”范围至5~6,得到滤渣2的主要成分除
 外还有;
外还有;
-
(3) “除杂”过程中加入
 的目的是;
的目的是;
-
(4) “沉锰”过程中发生反应的化学方程式为;
-
(5)
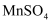 在水中的溶解度与温度的关系如图所示。由
在水中的溶解度与温度的关系如图所示。由 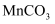 获得较纯净的
获得较纯净的  晶体的方法是:将
晶体的方法是:将 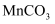 溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,(填操作名称),得到
溶于适量的稀硫酸,控制温度在80℃~90℃之间蒸发结晶,(填操作名称),得到  晶体,洗涤、烘干。晶体通常采用减压烘干的原因是;
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是; 
-
(6) 已知:
 。室温下,若溶液中
。室温下,若溶液中  ,欲使溶液中的
,欲使溶液中的  ,则需调节溶液pH范围为。
,则需调节溶液pH范围为。
 其中,白色沉淀B能溶于NaOH溶液。请回答:
其中,白色沉淀B能溶于NaOH溶液。请回答:
-
(1) 白色固体C的化学式是,蓝色溶液D中含有的溶质是(用化学式表示)。
-
(2) 化合物X的化学式是;化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式。
-
(3) 蓝色溶液A与
 作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。 ①写出该反应的离子方程式。
②设计实验验证该白色沉淀的组成元素。








