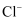第三单元 物质的检测 知识点题库
-
(1) 对上述物质进行分类,将符合条件的物质的编号填入相应的位置:
符合条件
对应物质
混合物
电解质,但熔融状态下不导电
电解质,但难溶于水
单质,本身能导电
-
(2) 从上述物质中选择合适的物质,发生下列反应,写出有关反应的离子方程式.
置换反应:;复分解反应:.
-
(3) 鉴别物质⑤和⑨最简单的方法是:.
甲 | 乙 | 丙 | 戊 | |
① | NH3 | O2 | NO | H2O |
② | Fe | H2O | H2 | Fe2O3 |
③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |


-
(1) A与NaOH溶液反应的离子方程式为;方程式中氧化剂为.
-
(2) 写出L的稀溶液与足量的J反应的化学方程式.
-
(3) 含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色.X的水溶液与NaHCO3溶液混合,反应的离子方程式为.
 B
B  C
C  D,回答下列问题:
D,回答下列问题:
-
(1) 若A为气态氢化物和D能通过化合反应生成一种盐则
①简述检验该盐中阳离子的方法
②写出实验室制取A的化学方程式
③写出由A生成B的化学方程式
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉.用方程式解释喷泉呈红色的原因
-
(2) 若A与B反应能生成一种淡黄色固体单质写出该反应的化学方程式
-
(3) 若A是金属单质,C是一种淡黄色固体写出C生成D的离子方程式.
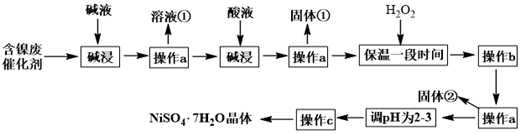
已知:Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
-
(1) “碱浸”过程中发生反应的离子方程式是。
-
(2) 操作a所用到的玻璃仪器有烧杯、、;操作c的名称为、、过滤、洗涤。
-
(3) 固体①是;加H2O2的目的是(用离子方程式表示)。
-
(4) 调pH为2-3时所加的酸是。
-
(5) 操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1 , 当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?(填“是”或“否”)。
-
(6) NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为。
【资料】 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色; 溶有溴的 |
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
【提出问题猜想】:
猜想①:溶液呈黄色是因为 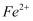 被氧化成
被氧化成  所致:
所致:
猜想②:溶液呈黄色是因为  被氧化成
被氧化成  所致。
所致。
-
(1) 【设计实验并验证】
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
试剂
酚酞试液、
 、无水酒精、
、无水酒精、 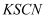 溶液
溶液方案
操作步骤
实验现象
结论
①
取所述黄色溶液于试管中,滴加并振荡
溶液变红色
猜想①正确
②
取所述黄色溶液于试管中,滴加并振荡
-
(2) 实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了
 的还原性比
的还原性比  (填“强”或“弱”)。
(填“强”或“弱”)。
-
(3) 【实验反思】
根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入
 并充分振荡后静置,观察到的现象是。
并充分振荡后静置,观察到的现象是。
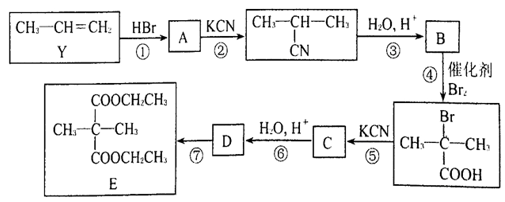
已知:R-X 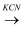 R-CN
R-CN  R-COOH(R代表烃基, X代表卤素原子)
R-COOH(R代表烃基, X代表卤素原子)
请回答下列问题:
-
(1) Y的系统命名是。B中的官能团名称是。
-
(2) 反应⑦的反应类型是。
-
(3) 反应①的化学方程式为。
-
(4) 写出E与足量NaOH溶液反应的化学方程式。
-
(5) Z是B的同分异构体,Z既能发生银镜反应,又能与金属钠反应,Z的结构共有种 (不考虑立体异构);若Z分子中只有3种不同化学环境的氢原子,写出其发生银镜反应的化学方程式。
-
(1) Zr(锆)在元素周期表中位于第五周期,与钛同族,基态Zr的价层电子排布式为。
-
(2) 亚氨基锂(Li2NH) 所含元素第一电离能最小的是 ,电负性最大的是 (填元素符号)。
-
(3) 咔唑(
 )的沸点比芴(
)的沸点比芴(  )高的主要原因是。
)高的主要原因是。
-
(4) ①NH3BH3 (氨硼烷,熔点104℃)与乙烷互为等电子体。NH3BH3的晶体类型为。其中B的杂化类型为,可通过测定该分子的立体构型。
②NH3BH3可通过环硼氨烷、CH4与H2O进行合成,键角: CH4H2O (填“> "或“<"),原因是。
-
(5) MgH2晶体属四方品系,结构如图,晶胞参数a =b= 450pm, c= 30lpm,原子坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。

①Mg2+的半径为72pm,则H+的半径为pm (列出计算表达式)
②用NA表示阿伏加德罗常数,MgH2晶体中氢的密度是标准状况下氢气密度的倍(列出计算表达式,氢气密度为0.089g·L-1)。
①X 溶于足量水中,得到固体Y和弱碱性溶液 Z。
②取固体 Y,加足量浓盐酸,加热,产生无色气体,析出红色固体,得溶液 W。
下列结论正确的是( )
 ,含有少量
,含有少量  等)与烟气脱硫进行联合处理并制备
等)与烟气脱硫进行联合处理并制备  的流程如下:
的流程如下: 
25℃时,几种金属离子沉淀时的pH如下:
| | | | | | |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |
-
(1)
 在酸化还原步骤中所发生反应的离子方程式分别为、。
在酸化还原步骤中所发生反应的离子方程式分别为、。
-
(2) 沉淀1为(填化学式),用双氧水处理滤液1时,通常在40~55℃下进行原因是。
-
(3) 氧化反应过程中常会有一定量的气泡产生,可能的原因是,调节溶液
 的目的是
的目的是
-
(4) “净化”时,加入
 的作用是
的作用是
-
(5) 滤液3中除
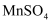 外,还含有少量
外,还含有少量  。
。  的溶解度曲线如图所示。据此判断,“操作I”应为、、洗涤、干燥。
的溶解度曲线如图所示。据此判断,“操作I”应为、、洗涤、干燥。 
-
(1) 上述十种物质中,属于电解质的有(填序号),属于非电解质的有(填序号)
-
(2) 除去③中少量②的操作是,化学方程式为;
-
(3) 现有100mL溶液中含Fe3+5.6g,则溶液中
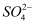 的物质的量浓度是;
的物质的量浓度是;
-
(4) 若在⑦中缓慢加入①的水溶液,产生的现象是。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常
用稳定剂吸收ClO2 , 生成NaClO2 , 使用时加酸只释放出ClO2一种气体;②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;③有关物质沸点如下表:
|
物质 |
CH3OH |
HCOOH |
ClO2 |
|
沸点 |
64.7 ℃ |
100.8 ℃ . |
11 ℃ |
请回答:
-
(1) 仪器d的名称是,仪器b的作用是。
-
(2) 反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式。
-
(3) 在ClO2释放实验中,发生的离子反应方程式是。
-
(4) 根据反应条件判断制备装置甲中需改进的一项措施是。
-
(5) NaOH吸收ClO2尾气,生成物质的量为1:1的两种阴离子,一种为ClO2- , 则另一种为。
-
(6) 自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取200.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000 mol/LNa2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62- ),达到滴定终点时用去20.00mLNa2S2O3标准溶液,测得该水样中ClO2的含量为mg/L( 保留一位小数)。

-
(1) A的系统名称是。
-
(2) 互为同分异构体的是;互为同系物的是。(用“A”、“B”、“C”或“D”回答)
-
(3) A的红外光谱图中有种键的振动吸收;B的核磁共振氢谱有个峰;能鉴别四种物质的物理方法是。

-
(1) 利用如图装置进行实验,为保证硫酸顺利滴下的操作是。
-
(2) 装置B中生成的Na2S2O3同时还生成CO2 , 反应的离子方程式为;在该装置中使用多孔球泡的目的是。
-
(3) 装置C的作用是检验装置B中SO2的吸收效果,C中可选择的试剂是__(填字母)。
a.H2O2溶液 b.溴水 c.KMnO4溶液 d.BaCl2溶液
-
(4) Na2S2O3溶液常用于测定废水中Ba2+浓度。
①取废水20.00mL,控制适当的酸度,加入足盐K2Cr2O7溶液,得到 BaCrO4 沉淀,过滤洗涤后用适量稀酸溶解,此时 CrO42-全部转化为Cr2O72-;再加过量 KI溶液,将Cr2O72- 充分反应;然后加入淀粉溶液作指示剂,用0.100 mol/L的Na2S2O3 溶液进行滴定:(I2 +2 S2O32-= S4O62-+ 2I-),滴定终点的现象为。平行滴定3次,消耗Na2S2O3 溶液的平均用量为18.00mL。则该废水中Ba2+ 的物质的量浓度为mol/L,
②在滴定过程中,下列实验操作会造成实验结果偏高的是(填字母)。
a.滴定管未用Na2S2O3溶液润洗
b.滴定终点时俯视读数
c.锥形瓶用蒸馏水洗涤后未进行干燥处理
d.滴定管尖嘴处滴定前无气泡,滴定终点发现有气泡
Ⅰ.取100mL的水样用微量的稀硫酸溶液调至pH为1-3,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝。
Ⅱ.在25mL滴定管加入1.0×10-4mol·L-1的Na2S2O3溶液。用该标准液滴定Ⅰ中溶液至终点,消耗Na2S2O3溶液10.00mL。
已知:ClO2在中性条件下还原产物为  ,在酸性条件下还原产物为Cl-。
,在酸性条件下还原产物为Cl-。
2 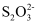 +I2=
+I2=  +2I-。
+2I-。
请回答下列问题:
-
(1) 操作Ⅱ,在向(填“酸式”或“碱式”)滴定管中注入Na2S2O3标准溶液前,滴定管需要检漏、和。
-
(2) 确定操作Ⅱ完全反应的现象。
-
(3) 在操作Ⅰ过程中,溶液呈蓝色,反应的离子方程式为。
-
(4) 水样中ClO2的浓度是mg·L-1。
-
(5) 如果滴定结束时仰视读取滴定中Na2S2O3溶液的体积,则测定结果将(填“偏大”、“偏小”或“不影响”)。
 D . 草木灰是农村广泛使用的一种农家肥,草木灰通常可以与铵态氮肥混合施用
D . 草木灰是农村广泛使用的一种农家肥,草木灰通常可以与铵态氮肥混合施用
| 序号 | 实验操作、现象 | 结论 |
| A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有 |
| B | 向一种未知溶液中滴加盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 未知溶液中一定含有 |
| C | 未知溶液进行焰色试验,焰色为黄色 | 该未知溶液中含钠元素 |
| D | 向紫色石蕊溶液中滴加氯水,溶液先变红后褪色 | Cl2具有酸性和漂白性 |
下列说法正确的是( )