实验4-4 饮料的研究 知识点题库
-
(1) 室温下,将0.15mol•L﹣1稀硫酸V1 mL与0.1mol•L﹣1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=.(溶液体积变化忽略不计)
-
(2) 室温下,某水溶液中存在的离子有:Na+、A﹣、H+、OH﹣ , 根据题意,回答下列问题:
①若由0.1mol•L﹣1 HA溶液与0.1mol•L﹣1 NaOH溶液等体积混合而得,则溶液的pH7.
②若溶液pH>7,则c(Na+) c(A﹣),理由是
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是(填选项代号).
A.若反应后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7 mol•L﹣1
B.若V1=V2 , 反应后溶液的pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2 .
-
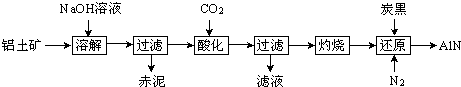
(1) “溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
赤泥的主要成分为(写出化学式).
-
(2) “酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
-
(3) “还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为.
-
(4) 现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示.
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号
Ⅰ
Ⅱ
Ⅲ
加入氮化铝样品的质量/g
4.1
8.2
12.3
生成氨气的体积/L(标准状况)
1.456
2.912
4.256
①该样品中AlN的质量分数为多少?(写出计算过程)
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成
二氧化碳,同时,MnO4﹣被还原成Mn2+ . 向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过
滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液V1mL,滴定中MnO4﹣ ,
被还原成Mn2+ .
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液V2mL.
-
(1) 加入锌粉的目的是
-
(2) 实验步骤二中加KMnO4的溶液的离子方程式为.

回答下列问题:
-
(1) 为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接):A→C→→→.
-
(2) 组装好仪器后,接下来进行的操作是;实验开始时通入N2的作用是.
-
(3) 关闭弹赞夹K1 , 打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.确认A中产生的气体中含有NO,依据的现象是;装置E的作用是.
-
(4) 根据上述实验,写出该反应的化学方程式:.如果没有装置C,对验证结论造成的影响是.
-
(5) 实验结柬后还需通入N2的作用是;如果向D中通入过量O2 , 则装置B中发生反应的离子方程式为.
请回答下列问题:

-
(1) 写出Al和NaOH溶液反应的离子方程式.
-
(2) 在点燃H2之前必须先进行.
-
(3) 实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了.他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少.于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是.
-
(4) 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g•mL﹣1、0.88g•mL﹣1、1.00g•mL﹣1 , 并据此对实验进行了改进.在改进后的实验中H2的生成速率.(填“减慢”或“加快”)
-
(5) 2.3g钠投入20mL水中完全反应放出的气体在标准状况下的体积是,所得溶液的物质的量浓度是.(不计溶液体积的变化)
①100mL 0.1mol•L﹣1H2SO4溶液 ②100mL 0.15mol•L﹣1 HCl溶液
③100mL 0.2mol•L﹣1 CH3COOH溶液 ④200mL 0.1mol•L﹣1 CH3COOH溶液
-
(1) pH最小的是 (填序号,下同);由水电离的H+浓度最大的是 ;与足量的Zn反应,生成H2最少的是 ;
-
(2) ①和③分别与100mL 0.2mol•L﹣1NaOH溶液反应,放出热量少的是 .

Ⅰ.制备高铁酸钾(夹持装置略)

-
(1) 装置A为氯气发生装置,其中盛放高锰酸钾的仪器名称为。
-
(2) 将除杂装置B补充完整并标明所用试剂。
-
(3) 装置C中Cl2与Fe(OH)3、KOH反应生成K2FeO4的化学方程式是。
-
(4) 实验时将装置C置于冰水浴中,其原因是。
-
(5) 实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是。
-
(6) Ⅱ.测定产品纯度
将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L−1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
①Cr(OH)4−+ FeO42-=Fe(OH)3↓+CrO42-+OH− ,
②,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
该粗产品中K2FeO4的质量分数为(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果(填“偏高”“偏低”或“无影响”)。
几种金属离子的氢氧化物沉淀pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 5.2 |
| Fe2+ | 7.6 | 9.7 |
| Ni2+ | 7.1 | 9.2 |
请回答下列问题:
-
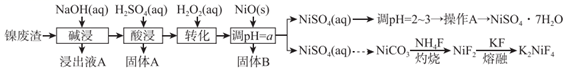
(1) “碱浸”过程中,为提高浸出率,可采取的措施是(写一种即可)。
-
(2) “转化”过程中加入H2O2的目的是(用离子方程式表示),经实验测定该过程温度高于40℃,转化率急速降低的原因可能是。
-
(3) 调节pH=a,其中a的取值范围是。
-
(4) 写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:,为避免污染环境,选择下列装置吸收尾气,最宜选择(填选项)。

-
(5) 准确称取ωg翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250mL溶液,取25.00mL所配溶液于锥形瓶中,用cmol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02mL、19.98mL、19.50mL,则翠矾的纯度为%(只列计算式,不考虑杂质反应)。
 的
的  溶液的
溶液的  ,故
,故  的
的  溶液的
溶液的  C .
C .  溶液呈中性,故
溶液呈中性,故  溶液也呈中性
D . 工业上通过电解熔融的
溶液也呈中性
D . 工业上通过电解熔融的  获得金属
获得金属  ,故也可以通过电解熔融的
,故也可以通过电解熔融的  获得金属
获得金属 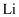
 、
、  、
、  、NO、
、NO、  中的两种或多种气体。现将此混合气体通过澄清石灰水,石灰水变浑浊,再将剩余气体通入装有空气的集气瓶中,集气瓶中气体很快变为红棕色。下列对于原混合气体成分的判断中正确的是( )
中的两种或多种气体。现将此混合气体通过澄清石灰水,石灰水变浑浊,再将剩余气体通入装有空气的集气瓶中,集气瓶中气体很快变为红棕色。下列对于原混合气体成分的判断中正确的是( )
 、
、  和NO
B . 肯定没有
和NO
B . 肯定没有  、
、  和
和  C . 可能有
C . 可能有  和
和  D . 肯定有NO,可能有
D . 肯定有NO,可能有 



